题目内容
【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。
(1)下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm)
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 |
|
| 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)用元素代号标出它们在周期表中对应位置__________(以下为周期表的一部分)
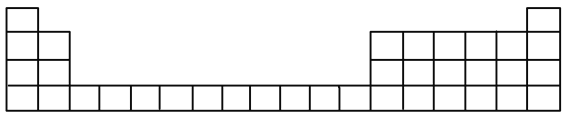
(2)![]() 元素处于周期表中______周期______族
元素处于周期表中______周期______族
(3)在元素周期表中______的分界处,可以找到制半导体材料的元素
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是______(填化学式)
(5)C、E形成化合物为______(填化学式)
【答案】 第三 IIIA )金属和非金属
第三 IIIA )金属和非金属 ![]()
![]() 、
、![]()
【解析】
根据半径和化合价,得出A为Mg,B为Al,C为S,D为Cl,E为O。
(1)用元素代号标出它们在周期表中对应位置如图:
 ,故答案为:
,故答案为: 。
。
(2)Al元素处于周期表中第三周期IIIA族,故答案为:第三;IIIA。
(3)在元素周期表中金属和非金属的分界处,可以找到制半导体材料的元素
(4) 从左到右,非金属增强,最高价氧化物对应水化物的酸性越强,因此上述五种元素中最高价氧化物对应水化物中酸性最强的是HClO4,故答案为:HClO4。
(5)S和O形成化合物为SO2、SO3,故答案为:SO2、SO3。

【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是_____(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____(用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
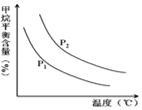
①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__(填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL﹣1,该温度下反应的平衡常数K值为_____。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
【题目】下列实验操作对应的实验现象及解释或结论都正确的是( )
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 | 溶液变为黄色 | 氧化性:H2O2>Fe3+ |
B | 向5mL1mol/L NaOH溶液中滴加5滴1mol/L MgCl2溶液,然后再滴加足量的1mol/L CuCl2溶液 | 先产生白色沉淀,然后产生蓝色沉淀 | Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 2NO2(g) |
D | 向一定量酸性KMnO4溶液中加入乙二醇(HOCH2CH2OH) | 溶液紫色褪去 | 乙二醇被氧化为乙二酸 |
A. A B. B C. C D. D
【题目】用石墨电极完成下列电解实验。
实验装置 | 实验现象 |
| a处试纸变蓝; b处变红,局部褪色; c处无明显变化; d处试纸变蓝 |
下列对实验现象的解释或推测不合理的是
A. a为电解池的阴极
B. b处有氯气生成,且与水反应生成了盐酸和次氯酸
C. c处发生了反应:Fe-3e- = Fe3+
D. d处:2H2O+2e-=H2↑+2OH-