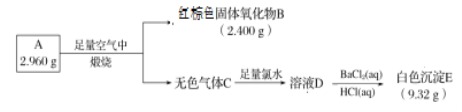
题目内容
【题目】厌氧氨化法是一种新型的氨氮去除技术,下列说法中正确的是( )
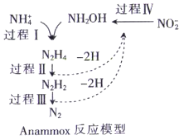
A.1molNH4+中所含的质子总数为10NA
B.1mol联氨(N2H4)中含有5mol共用电子对
C.NH2OH中既含有极性键也含有非极性键
D.该方法每处理1molNH4+,需要的NO2-为0.5mol
【答案】B
【解析】
A.1mol NH4+ 所含的质子总数为11NA,故A错误;
B.1个联氨中含有4个N-H,1个N-N键,所以1mol联氨(N2H4)中含有5mol共价键,故B正确;
C.NH2OH中既含有极性键如N-H键、O-H键,不含有非极性键,故C错误;
D.由图可知经过过程 I、II、III,(假设每步转化均完全)1mol铵根离子与1molNH2OH发生氧化还原反应生成1mol氮气,因此根据电子守恒,处理1mol铵根离子需要的NO2-为1mol,故D错误;
故选B。

【题目】(1)某学生为了探究锌与盐酸反应过程中的速率变化,在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 50 | 120 | 232 | 290 | 310 |
①上述实验过程中,反应速率最大时间段是________(选填字母作答),该时间段反应速率最大的主要原因是________________________________________________________。
A.0~1min B.1~2min C.2~3min D.3~4min E.4~5min
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率___________________(假设反应过程中溶液体积不变)。
(2)某温度下在容积为1L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是______________________________________________。
②该反应达到平衡状态的标志是________。
A.X的浓度不再改变
B.Y的体积分数在混合气体中保持不变
C.容器内气体的总压强保持不变
D.容器内气体的总质量保持不变
③反应进行到2min时,Y的转化率为_____________。
(3)燃料电池可以将气体燃料和氧气直接反应产生电能,其效率高、污染低,是一种很有前途的能源利用方式。但传统燃料电池使用氢气为燃料,而氢气既不易制取又难以储存,导致燃料电池成本居高不下。科研人员尝试用便宜的甲烷、乙烷等碳氢化合物为燃料,设计出新型燃料电池,使其成本大大低于以氢气为燃料的传统燃料电池。请写出以甲烷为燃料、硫酸为电解质溶液的该新型燃料电池工作时负极的电极反应方程式_________。
【题目】CO2的捕捉、封存与再利用是实现温室气体减排的重要途径之一。请回答:
(1)二氧化碳的电子式为__________。
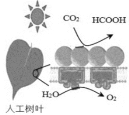
(2)一种正在开发的利用二氧化碳制取甲酸(HCOOH)的途径如图所示,图中能量主要转化方式为_____________ ,CO2和H2O转化为甲酸的化学方程式为____________。
(3)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。
①恒容容器中,能加快该反应速率的是_______。
a.升高温度 b.从体系中分离出CH3OH c.加入高效催化剂 d.降低压强
②在体积为2L的密闭容器中,充入1molCO2和3molH2,测得CO2的物质的量随时间变化如图所示。从反应开始到5min末,用H2浓度变化表示的平均反应速率________________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
③在相同温度、恒容的条件下,能说明该反应已达平衡状态的是_______(填序号)。
a.CO2、H2、CH3OH、H2O的浓度均不再改变化
b.n(CO2):n(H2):n(CH3OH):n(H2O)=1:1:1:1
c.容器中混合气体的密度不变
d.v消耗(H2)=3v消耗(CH3OH)
e.体系压强不变
(4)下列一些共价键的键能如下表所示:
化学键 | H-H | H-O | C=O | C-H | C-O |
键能kJ/mol | 436 | 463 | 803 | 414 | 326 |
反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),______(填“吸收”或“放出”) 的热量为_____kJ
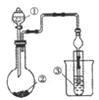
【题目】利用图示装置进行实验,不能得出相应结论的是( )
溶液① | 固体② | 溶液③ | 实验结论 |
| |
A | 稀硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si | |
B | 浓盐酸 | KMnO4 | Na2S | 氧化性:KMnO4>Cl2>S | |
C | 浓H2SO4 | Cu | 氢硫酸 | 溶液变浑浊 | |
D | 浓氨水 | CaO | AlCl3 | 可以制备Al(OH)3 |
A. A B. B C. C D. D