题目内容
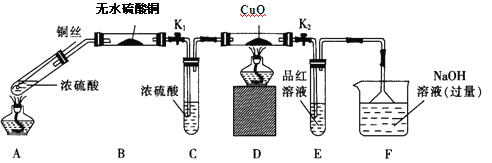
【题目】磁性材料A由两种元素组成,为探究其组成和性质,设计并完成如下实验:
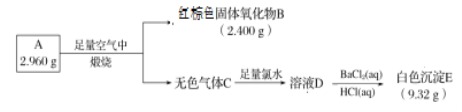
(1) A的化学式为______。
(2) 用化学方程式表达气体C与氯水反应生成D的过程:________。
(3) B溶于盐酸后生成的物质F可用于净水,其原因是____________。
【答案】Fe3S4 Cl2+SO2+2H2O=H2SO4+2HCl Fe3+水解生成了氢氧化铁胶体,能吸附水中悬浮的小颗粒,达到净水的目的
【解析】
无色气体C与足量的氯水反应得到溶液D,D中加入氯化钡溶液和盐酸溶液,有白色沉淀E生成,故E为BaSO4,D为硫酸和盐酸的混合液,C为二氧化硫。B溶于盐酸后生成的物质F可用于净水,再结合其A由两种元素组成的磁性材料,可知,B为三氧化二铁,然后分析;
(1)氧化铁的质量为2.400g,其物质的量为![]() ,含铁原子的物质的量为0.030mol,则铁的质量为0.030 mol×56g/mol=1.680g,则化合物中硫元素的质量为2.960-1.680=1.280g,硫的物质的量为
,含铁原子的物质的量为0.030mol,则铁的质量为0.030 mol×56g/mol=1.680g,则化合物中硫元素的质量为2.960-1.680=1.280g,硫的物质的量为![]() ,则铁与硫的物质的量比为0.030:0.040=3:4,则化学式为:Fe3S4;
,则铁与硫的物质的量比为0.030:0.040=3:4,则化学式为:Fe3S4;
(2)二氧化硫与氯气在水中发生氧化还原反应生成硫酸和盐酸,氯气作氧化剂,二氧化硫作还原剂,反应的化学方程式为:Cl2+SO2+2H2O=H2SO4+2HCl;
(3) B为三氧化二铁,溶于盐酸后生成的物质F可用于净水即为三价铁离子水解:Fe3++3H2O![]() Fe(OH)3+3H+,Fe3+水解生成了氢氧化铁胶体,能吸附水中悬浮的小颗粒,达到净水的目的。
Fe(OH)3+3H+,Fe3+水解生成了氢氧化铁胶体,能吸附水中悬浮的小颗粒,达到净水的目的。

练习册系列答案
相关题目