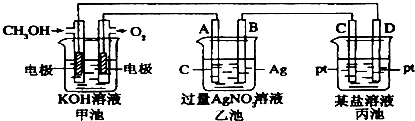
题目内容
20.实验室可用浓盐酸和二氧化锰制氯气:MnO2+4HCl$\stackrel{△}{→}$MnCl2+Cl2↑+2H2O(1)取17.4g二氧化锰与200ml37%的盐酸(密度为1.19g/ml)起反应,生成的氯气在标准状况下体积为多少升?
(2)向反应后的溶液中加入足量的AgNO3溶液,生成的沉淀质量为多少克?
分析 (1)17.4g二氧化锰和37%浓盐酸200mL(密度为1.19g/mL)充分反应,二氧化锰物质的量为0.2mol,浓盐酸中氯化氢物质的量=$\frac{200ml×1.19g/ml×37%}{36.5g/mol}$=2.4mol;盐酸中氯化氢过量,MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;依据二氧化锰计算氯气物质的量为0.2mol,所以标准状况下,氯气的体积为4.48L;
(2)根据Ag++Cl-=AgCl↓,而溶液中的氯离子的物质的量是:2.4mol-0.2mol×2=2mol,所以氯化银的物质的量为2mol,从而求出质量.
解答 解:(1)17.4g二氧化锰和37%浓盐酸200mL(密度为1.19g/mL)充分反应,二氧化锰物质的量为0.2mol,浓盐酸中氯化氢物质的量=$\frac{200ml×1.19g/ml×37%}{36.5g/mol}$=2.4mol;盐酸中氯化氢过量,MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;依据二氧化锰计算氯气物质的量为0.2mol,所以标准状况下,VCl2=4.48L,答:生成的氯气在标准状况下体积为4.48L;
(2)根据Ag++Cl-=AgCl↓,而溶液中的氯离子的物质的量是:2.4mol-0.2mol×2=2mol,所以氯化银的物质的量为2mol,m(Ag Cl)=143.5g/mol×2mol=287g,答:生成的沉淀质量为287g.
点评 本题考查化学方程式有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
8.下列化学用语表达正确的是( )
| A. | 硫原子的结构示意图: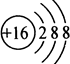 | |
| B. | 氨气(NH3)中氮元素的化合价:+3 | |
| C. | 氧化铁的化学式:FeO | |
| D. | 碳酸氢钠电离方程式:NaHCO3═Na++HCO3- |
5. 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
步骤一:配制100mL 0.10mol/L NaOH标准溶液..
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
(1)滴定达到终点的现是加入最后一滴氢氧化钠溶液,溶液由无色恰好变成浅红色,且半分钟内不褪色;
此时锥形瓶内溶液的pH的范围是8.2~10.
(2)根据上述数据,可计算出该盐酸的浓度为0.11mol/L.
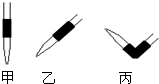
(3)排去碱式滴定管中气泡的方法应采用如图的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有C
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
F.用于配制标准溶液的NaOH固体中含有少量Na2CO3.
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:步骤一:配制100mL 0.10mol/L NaOH标准溶液..
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.02 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 21.98 | 20.00 |
此时锥形瓶内溶液的pH的范围是8.2~10.
(2)根据上述数据,可计算出该盐酸的浓度为0.11mol/L.
(3)排去碱式滴定管中气泡的方法应采用如图的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有C
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
F.用于配制标准溶液的NaOH固体中含有少量Na2CO3.
9.下列化学用语正确的是( )
| A. | H2O2的电子式: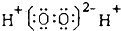 | |
| B. | 次氯酸的电子式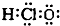 | |
| C. | N2的结构式:N≡N | |
| D. | 熔融时NaHSO4的电离方程式为:NaHSO4=Na++H++$S{{O}_{4}}^{2-}$ |
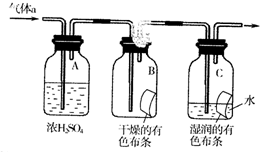 氯气是一种化学性质活泼的非金属单质,工业上
氯气是一种化学性质活泼的非金属单质,工业上