题目内容
【题目】氮有多种化合价,能形成多种化合物.工业上用活性炭还原法处理NO,有关反应为:C(s)+2NO(g)N2(g)+CO2(g).向密闭的2L容器中,加入NO和足量的活性炭,恒温条件下反应.
(1)若2min内气体密度增大了1.2g/L,则氮气的平均反应速率为_____mol/(Lmin).
(2)该化学平衡常数表达式K=_____,已知升高温度时,K增大,则正反应为_____(填“吸热”或“放热”)反应.
(3)在温度不变的情况下,要提高NO的平衡转化率,可以采取的措施是_______.
(4)下列各项能判断该反应达到平衡的是______(填序号字母).
a.容器内压强保持不变 b.2v正(NO)=v逆(N2)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
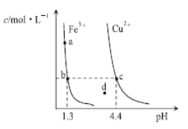
(5)已知NaNO2溶液呈碱性,则NaNO2溶液中离子浓度由大到小的顺序是______.
(6)常温下,NaOH溶液和HNO2溶液等体积混合后,所得溶液的pH=7,下列关系正确的是________.
a.c(Na+)>c(NO2﹣) b.c(Na+)=c(NO2﹣)
c.c(Na+)<c(NO2﹣) d.c(Na+)>c(OH﹣)
【答案】0.05 ![]() 吸热 移走生成物N2和(或)CO2 cd c(Na+)>c(NO2﹣)>c(OH﹣)>c(H+) bd
吸热 移走生成物N2和(或)CO2 cd c(Na+)>c(NO2﹣)>c(OH﹣)>c(H+) bd
【解析】
(1)气体密度增大了1.2g/L,可以计算出固体C的质量减小了2.4g,可以计算氮气的物质的量的变化量,进而计算反应速率;
(2)化学平衡常数K=![]() ,对于吸热反应,温度升高,K增大;
,对于吸热反应,温度升高,K增大;
(3)在温度不变的情况下,要提高NO的平衡转化率,只要是化学平衡正向移动即可;
(4)达到化学平衡状态时,正逆反应速率相等,各个组分的浓度不变,据此回答判断;
(5)NaNO2溶液呈碱性,是因为亚硝酸根离子水解导致的,据此回答;
(6)根据溶液中的电荷守恒以及离子浓度的大小关系来判断。
(1)根据题意,气体密度增大了1.2g/L,容器的体积为2L,计算出固体C的质量减小了2.4g,则生成氮气的物质的量是![]() =0.2mol,所以氮气表示的反应速率v=
=0.2mol,所以氮气表示的反应速率v=![]() =
= =0.05mol/(Lmin);
=0.05mol/(Lmin);
(2)化学平衡常数K=![]() =
=![]() ,温度升高,K增大,则该反应是吸热反应;
,温度升高,K增大,则该反应是吸热反应;
(3)在温度不变的情况下,减小产物的浓度可以让平衡正向移动,从而提高NO的平衡转化率,故答案为:移走生成物N2和(或)CO2;
(4)a.该反应是前后系数和相等的反应,当容器内压强保持不变,不一定平衡,故a错误;
b.当2v正(NO)=v逆(N2)时,v正(N2)≠v逆(N2),则证明反应未达到平衡状态,故b错误;
c.容器内CO2的体积分数不变,证明达到了平衡,故c正确;
d.混合气体的密度ρ=![]() ,质量是变化的,V不变,所以当密度保持不变,证明达到了平衡,故d正确;
,质量是变化的,V不变,所以当密度保持不变,证明达到了平衡,故d正确;
故答案为cd;
(5)NaNO2溶液呈碱性,c(OH﹣)>c(H+),是因为亚硝酸根离子水解导致的,所以c(Na+)>c(NO2﹣),即c(Na+)>c(NO2﹣)>c(OH﹣)>c(H+),故答案为:c(Na+)>c(NO2﹣)>c(OH﹣)>c(H+);
(6)NaOH溶液和HNO2溶液等体积混合后,所得溶液的pH=7,则c(OH﹣)=c(H+),根据电荷守恒,则c(Na+)=c(NO2﹣),离子浓度关系是:c(Na+)=c(NO2﹣)>c(OH﹣)=c(H+),所以c(Na+)>c(OH﹣),故答案为bd。

【题目】写出或完成下列热化学方程式。
(1)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ 的热量。写出CH4燃烧的热化学方程式__________。
(2)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。下表是一些化学键的键能。
化学键 | C-H | C-F | H-F | F-F |
键能kJ/mol | 414 | 489 | 565 | 155 |
根据键能数据估算下列反应:CH4(g) + 4F2(g)=CF4(g) + 4HF(g)的反应热△H为_____。
(3)1840年瑞士的化学家盖斯(Hess)在总结大量实验事实(热化学实验数据)的基础上提出:“定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。”
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
请写出CO还原FeO的热化学方程式:______。
(4)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为__________;
②氢气燃烧热的热化学方程式为________;
(5)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) ΔH2;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1。
则ΔH2=_______kJ·mol-1;
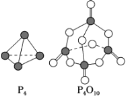
(6)白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH为_____。
(7)同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
①P4(白磷,s)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(红磷,s)+5/4O2(g)=1/4P4O10(s) ΔH2=-738.5 kJ·mol-1
相同状况下,能量较低的是________;白磷的稳定性比红磷________(填“大”或“小”)。
【题目】无水硫酸铜在加热至650℃时开始分解生成氧化铜和气体.某活动小组通过实验,探究不同温度下气体产物的组成.实验装置如下:
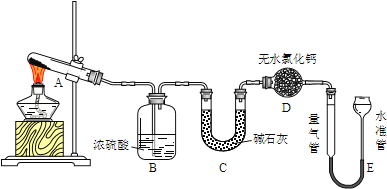
每次实验后均测定B、C质量的改变和E中收集到气体的体积.实验数据如下(E中气体体积已折算至标准状况):
实验组别 | 温度 | 称取CuSO4质量/g | B增重质量/g | C增重质量/g | E中收集到气体/mL |
① | T1 | 0.640 | 0.320 | 0 | 0 |
② | T2 | 0.640 | 0 | 0.256 | V2 |
③ | T3 | 0.640 | 0.160 | Y3 | 22.4 |
④ | T4 | 0.640 | X4 | 0.192 | 33.6 |
(1)实验过程中A中的现象是______.D中无水氯化钙的作用是_______.
(2)在测量E中气体体积时,应注意先_______,然后调节水准管与量气管的液面相平,若水准管内液面高于量气管,测得气体体积______(填“偏大”、“偏小”或“不变”).
(3)实验①中B中吸收的气体是_____.实验②中E中收集到的气体是______.
(4)推测实验②中CuSO4分解反应方程式为:_______.
(5)根据表中数据分析,实验③中理论上C增加的质量Y3=_______g.
(6)结合平衡移动原理,比较T3和T4温度的高低并说明理由________.