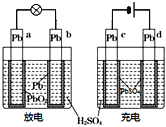
��Ŀ����
����Ŀ��������Ũ���ᷢ�����·�Ӧ��H2S+H2SO4(Ũ)��S��+SO2��+2H2O���������£���������Ũ�����ֻᷢ�����·�Ӧ��S+2H2SO4(Ũ)![]() 3SO2��+2H2O
3SO2��+2H2O
���㣺
(1)��98%Ũ����ɱ�ʾΪH2SO4aH2O����a=__����Ҫ�Ѹ�Ũ����ת��ΪH2SO4H2O����98%Ũ���������ˮ��������Ϊ_____��
(2)һ�������£���0.1mol H2S����ͨ������Ũ�����У�����b mol SO2���� b��ȡֵ��Χ��_______��
(3)��50mL��4.0mol/L��NaOH��Һ�У�ͨ��H2S���岢��ַ�Ӧ��Ȼ��С���������õ������ᾧˮ�İ�ɫ���壮ͨ��H2S�����ʵ���Ϊx mol�����ɵİ�ɫ���������Ϊ7.9g��ͨ������ȷ����ɫ����Ŀ��ܳɷּ�ÿ�ֳɷֵ�����(�������һλС��)_______��
���𰸡�![]() 25��4 0.1��b��0.4 NaOH��4g��Na2S��3.9 g �� Na2S��7.6 g��NaHS��0.3 g
25��4 0.1��b��0.4 NaOH��4g��Na2S��3.9 g �� Na2S��7.6 g��NaHS��0.3 g
��������
��1���������ᡢˮ�����ʵ����ȼ��㣻
(2)����������������bֵ��
(3) NaOH��Һͨ���������壬��Ӧ������ʿ����п�����NaOH��Na2S��Na2S��NaHS����ֻ��NaHS����ֻ��Na2S���������۷����������
��1��Ũ�������������Ϊ98%����ÿ100gŨ�����к�������98g�����ʵ���Ϊ��![]() =1mol������ˮ2g�����ʵ���Ϊ��
=1mol������ˮ2g�����ʵ���Ϊ��![]() =
=![]() mol����a=
mol����a=![]() ����Ҫ�Ѹ�Ũ����ת��ΪH2SO4H2O���������ˮ�����ʵ�����1:1������Ҫ����ˮΪ18��2=16g����Ũ���������ˮ��������Ϊ��100��16=25��4��
����Ҫ�Ѹ�Ũ����ת��ΪH2SO4H2O���������ˮ�����ʵ�����1:1������Ҫ����ˮΪ18��2=16g����Ũ���������ˮ��������Ϊ��100��16=25��4��
��2��H2S+H2SO4��Ũ����S��+SO2��+2H2O����S+2H2SO4��Ũ��![]() 3SO2��+2H2O�ڣ���ֻ������Ӧ�٣���ô���ɵĶ�����������ʵ������ڼ�����������ʵ�����Ϊ0.1mol��
3SO2��+2H2O�ڣ���ֻ������Ӧ�٣���ô���ɵĶ�����������ʵ������ڼ�����������ʵ�����Ϊ0.1mol��
����Ӧ�������ɵ�S���ʼ���������Ӧ�ڣ���ô���ɶ����������ʵ���Ϊ0.4mol����b�ķ�Χ�ǣ�0.1��b��0.4��
��3��50mL 4.0mol/L��NaOH�����ʵ���Ϊ��0.05��4=0.2mol���������ⱻ��ȫ���գ�������������Ҳȫ����Ӧ�������õĹ������ʿ�����NaOH��Na2S��Na2S��NaHS����ֻ��NaHS����ֻ��ֻ��Na2S��
�����������õĹ��������NaOHΪamol��Na2SΪbmol��������ԭ�ӵ��غ���У�a+2b=0.2mol �٣�40a+78b=7.9g �ڣ����a=0.1mol��b=0.05mol����NaOH������m=nM=0.1mol��40g/mol=4g��Na2S������m=nM=0.05mol��78g/mol=3.9g��
�����������õĹ��������Na2SΪamol��NaHSΪbmol��������ԭ�ӵ��غ���У�2a+b=0.2mol �٣�78a+56b=7.9g �ڣ����a=![]() mol��b=
mol��b=![]() mol����Na2S������m=nM=
mol����Na2S������m=nM=![]() mol��78g/mol=7.6g��NaHS������m= 7.9g��7.6g=0.3g��
mol��78g/mol=7.6g��NaHS������m= 7.9g��7.6g=0.3g��
�����������õĹ���������NaHS����ôNaHSΪ0.2mol������ӦΪ��0.2mol��56g/mol=11.2g�����������⣬���������
�����������õĹ���������Na2S����ôNa2SΪ0.1mol������ӦΪ��0.1mol��78g/mol=7.8g�����������⣬���������

����Ŀ������п����ΪʳƷпǿ������ԭ�ϡ���ҵ�ϳ�����п����������п����п�����Ҫ�ɷ���ZnCO3������������Fe2O3��FeCO3��MgO��CaO�ȣ�������������ʾ�����£�
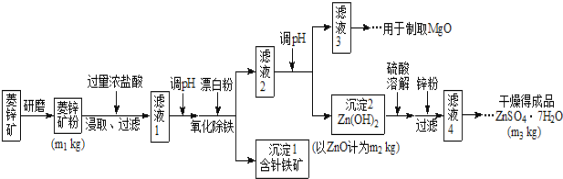
��1������п����ĥ�ɷ۵�Ŀ����_______________________��
��2��������Goethite�����Ե¹�ʫ�˸�£�Goethe�����������ģ����Ԫ����Fe��O��H����ѧʽ��Ϊ89����ѧʽ��______________��
��3�������±����ݣ���������Һ2����pHʱ�������Ͽ�ѡ�õ��������Ϊ________________
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
��ʼ������pH | 10��4 | 6��4 | �� | �� |
������ȫ��pH | 12��4 | 8��0 | �� | �� |
��ʼ�ܽ��pH | �� | 10��5 | �� | �� |
��ҵ�ϴ�����Һ3����ȡMgO�����У�����ʵķ�Ӧ����______________��ѡ����ţ���
A������ʯ�� B��ʯ���� C��������Һ D���ռ���Һ
����Һ4��֮��IJ�������Ϊ______��_______�����ˣ�ϴ�ӣ����
��4������ͼ�����ݣ���п�����ZnCO3 ����������������________��
����Ŀ����֪��K3[Fe(CN)6]��Һ�Ǽ���Fe2+���Լ�������Һ�д���Fe2+����������ɫ��������0.2mol/L��KI��Һ��0.05mol/LFe2(SO4)3��Һ�������Ϻ�ȡ���Һ�ֱ��������ʵ�飬��˵����Һ�д��ڻ�ѧƽ�⡰2Fe3++2I-![]() 2Fe2++I2������
2Fe2++I2������
ʵ���� | ʵ����� | ʵ������ |
�� | ����KSCN��Һ | ��Һ���ɫ |
�� | ����AgNO3��Һ | �л�ɫ�������� |
�� | ����K3[Fe(CN)6]��Һ | ����ɫ�������� |
�� | ���������Һ | ��Һ����ɫ |
A.��B.������C.������D.������
����Ŀ������ͼ��ʾװ�ý�������ʵ�飺��������Һ��ε�����У�Ԥ���������ʵ���������
ѡ�� | �������� | �������� | Ԥ����е����� |
|
A�� | ϡ���� | Ũ̼������Һ | ������������ | |
B�� | Ũ���� | ��ɰֽ��ĥ�������� | ������������ɫ���� | |
C�� | �Ȼ�������Һ | �������ƹ��� | ��������ͺ��ɫ���� | |
D�� | ����������Һ | ��������ĩ | ������ɫ���� |
A.AB.BC.CD.D