题目内容
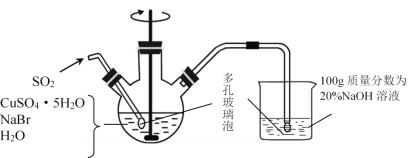
【题目】无水硫酸铜在加热至650℃时开始分解生成氧化铜和气体.某活动小组通过实验,探究不同温度下气体产物的组成.实验装置如下:
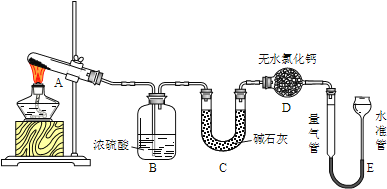
每次实验后均测定B、C质量的改变和E中收集到气体的体积.实验数据如下(E中气体体积已折算至标准状况):
实验组别 | 温度 | 称取CuSO4质量/g | B增重质量/g | C增重质量/g | E中收集到气体/mL |
① | T1 | 0.640 | 0.320 | 0 | 0 |
② | T2 | 0.640 | 0 | 0.256 | V2 |
③ | T3 | 0.640 | 0.160 | Y3 | 22.4 |
④ | T4 | 0.640 | X4 | 0.192 | 33.6 |
(1)实验过程中A中的现象是______.D中无水氯化钙的作用是_______.
(2)在测量E中气体体积时,应注意先_______,然后调节水准管与量气管的液面相平,若水准管内液面高于量气管,测得气体体积______(填“偏大”、“偏小”或“不变”).
(3)实验①中B中吸收的气体是_____.实验②中E中收集到的气体是______.
(4)推测实验②中CuSO4分解反应方程式为:_______.
(5)根据表中数据分析,实验③中理论上C增加的质量Y3=_______g.
(6)结合平衡移动原理,比较T3和T4温度的高低并说明理由________.
【答案】白色固体变黑 吸收水蒸气,防止影响C的质量变化 冷却至室温 偏小 SO3 O2 2CuSO4![]() 2CuO+2SO2↑+O2↑ 0.128 T4温度更高,因为SO3分解为SO2和O2是吸热反应,温度高有利于生成更多的O2
2CuO+2SO2↑+O2↑ 0.128 T4温度更高,因为SO3分解为SO2和O2是吸热反应,温度高有利于生成更多的O2
【解析】
(1)根据无水硫酸铜在加热至650℃时开始分解生成氧化铜和气体分析A中的现象,根据碱石灰和无水氯化钙的作用分析;
(2)气体温度较高,气体体积偏大,应注意先冷却至室温,若水准管内液面高于量气管,说明内部气压大于外界大气压,测得气体体积偏小;
(3)实验中B中浓硫酸的作用是吸收三氧化硫气体,C的作用是吸收二氧化硫,E的作用是收集到氧气;
(4)0.64g硫酸铜的物质的量为![]() =0.004mol,分解生成氧化铜的质量为:0.004mol×80g/mol=0.32g;SO2的质量为:0.256g,物质的量为:
=0.004mol,分解生成氧化铜的质量为:0.004mol×80g/mol=0.32g;SO2的质量为:0.256g,物质的量为:![]() =0.004mol,氧气的质量为:0.64﹣0.32﹣0.256=0.064g,物质的量为:
=0.004mol,氧气的质量为:0.64﹣0.32﹣0.256=0.064g,物质的量为:![]() =0.002mol,CuSO4、CuO、SO2、O2的物质的量之比等于2:2:2;1,则实验②中CuSO4分解反应方程式为2CuSO4
=0.002mol,CuSO4、CuO、SO2、O2的物质的量之比等于2:2:2;1,则实验②中CuSO4分解反应方程式为2CuSO4![]() 2CuO+2SO2↑+O2↑;
2CuO+2SO2↑+O2↑;
(5)0.64g硫酸铜的物质的量为![]() =0.004mol,分解生成氧化铜的质量为:0.004mol×80g/mol=0.32g;SO3的质量为:0.16g,氧气的质量为:
=0.004mol,分解生成氧化铜的质量为:0.004mol×80g/mol=0.32g;SO3的质量为:0.16g,氧气的质量为:![]() 32=0.032g,根据质量守恒实验③中理论上C增加的质量Y3=0.64﹣0.32﹣0.16﹣0.032=0.128g;
32=0.032g,根据质量守恒实验③中理论上C增加的质量Y3=0.64﹣0.32﹣0.16﹣0.032=0.128g;
(6)根据表中实验③④的数据可知,T4温度生成氧气更多,因为SO3分解为SO2和O2是吸热反应,温度高有利于生成更多的O2。
(1)因为无水硫酸铜在加热至650℃时开始分解生成氧化铜和气体,故实验过程中A中的现象是白色固体变黑,因为碱石灰能够吸水,D中无水氯化钙的作用是 吸收水蒸气,防止装置E中的水进入装置C,影响C的质量变化,故答案为:白色固体变黑;吸收水蒸气,防止影响C的质量变化;
(2)加热条件下,气体温度较高,在测量E中气体体积时,应注意先冷却至室温,若水准管内液面高于量气管,说明内部气压大于外界大气压,测得气体体积偏小,故答案为:冷却至室温 偏小;
(3)实验中B中浓硫酸的作用是吸收三氧化硫气体,C的作用是吸收二氧化硫,E的作用是收集到氧气,故答案为:SO3;O2;
(4)0.64g硫酸铜的物质的量为![]() =0.004mol,分解生成氧化铜的质量为:0.004mol×80g/mol=0.32g;SO2的质量为:0.256g,物质的量为:
=0.004mol,分解生成氧化铜的质量为:0.004mol×80g/mol=0.32g;SO2的质量为:0.256g,物质的量为:![]() =0.004mol,氧气的质量为:0.64﹣0.32﹣0.256=0.064g,物质的量为:
=0.004mol,氧气的质量为:0.64﹣0.32﹣0.256=0.064g,物质的量为:![]() =0.002mol,CuSO4、CuO、SO2、O2的物质的量之比等于2:2:2;1,则实验②中CuSO4分解反应方程式为2CuSO4
=0.002mol,CuSO4、CuO、SO2、O2的物质的量之比等于2:2:2;1,则实验②中CuSO4分解反应方程式为2CuSO4![]() 2CuO+2SO2↑+O2↑;
2CuO+2SO2↑+O2↑;
(5)0.64g硫酸铜的物质的量为![]() =0.004mol,分解生成氧化铜的质量为:0.004mol×80g/mol=0.32g;SO3的质量为:0.16g,氧气的质量为:
=0.004mol,分解生成氧化铜的质量为:0.004mol×80g/mol=0.32g;SO3的质量为:0.16g,氧气的质量为:![]() 32=0.032g,实验③中理论上C增加的质量Y3=0.64﹣0.32﹣0.16﹣0.032=0.128g;
32=0.032g,实验③中理论上C增加的质量Y3=0.64﹣0.32﹣0.16﹣0.032=0.128g;
(6)根据表中实验③④的数据可知,T4温度生成氧气更多,因为SO3分解为SO2和O2是吸热反应,温度高有利于生成更多的O2,故T4温度更高,故答案为:T4温度更高,因为SO3分解为SO2和O2是吸热反应,温度高有利于生成更多的O2。

 金钥匙试卷系列答案
金钥匙试卷系列答案