题目内容
16.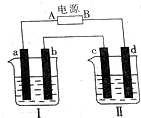 如图所示装置中,烧杯Ⅰ、Ⅱ中分别盛有200g 9.4%的Cu(NO3)2溶液和足量的饱和K2SO3溶液,所用电极均为惰性电极,请回答下列问题:
如图所示装置中,烧杯Ⅰ、Ⅱ中分别盛有200g 9.4%的Cu(NO3)2溶液和足量的饱和K2SO3溶液,所用电极均为惰性电极,请回答下列问题:(1)电解一段时间后,a电极产生0.56L(标准状况下)气体,则A为电源的正极,此时烧杯Ⅰ中溶液的质量为196g;
(2)电解后烧杯Ⅱ中析出一种无色钾盐晶体(不含氢元素),其摩尔质量为238 g•mol-1,该盐中钾的含量为32.8%,且钾与硫元素原子的物质的量之比为1:1,则该钾盐的化学式为K2S2O6,d电极上产生气体的化学式为2H++2e-=H2↑,c电极的电极反应式为2SO32--2e-=S2O62-.
分析 (1)在电解池中,阳极上发生失电子的氧化反应,阴极上发生的电子的还原反应,根据离子的放电顺序以及电极反应现象确定电极,根据电极反应式结合电子转移情况进行计算;
(2)据钾盐的质量、钾元素的百分含量以及钾元素和硫元素物质的量关系计算钾元素以及硫元素的物质的量,根据质量守恒,计算氧元素的物质的量,物质的量之比等于原子个数之比,确定分子式,根据电解池的阳极、阴极离子的放电顺序以及工作原理书写电极反应式.
解答 解:(1)Ⅰ中是Cu(NO3)2溶液,a电极产生0.56L(标准状况下)气体,说明是电解池的阳极,和电源的正极相连,则A为电源的正极,阳极上发生反应:4OH--4e-
O2↑+2H20,阴极反应:Cu2++2e-=Cu,m[Cu(NO3)2]=200g×9.4%=18.8g,n[Cu(NO3)2]=0.1mol,0.1mol铜离子得电子的物质的量是0.2mol,根据阳极上的反应,产生氧气的物质的量是$\frac{5.6L}{22.4L/mol}$=0.025mol,转移电子是0.1mol,据Cu2++2e-=Cu,所以析出金属铜0.05mol,溶液的质量=200g-0.05mol×64g/mol-0.025mol×32g/mol=196g,故答案为:正;196;
(2)钾盐晶体(不含氢元素)摩尔质量为238 g•mol-1,该盐中钾的含量为32.8%,则n(K)=$\frac{238×32.8%}{39}$=2mol,且钾与硫元素原子的物质的量之比为1:1,则n(S)=2mol,所以n(O)=$\frac{238-2×39-2×32}{16}$=6,化学式为:K2S2O6,d电极是电解池的阴极,发生还原反应,电极反应为:2H++2e-=H2↑,c为阳极,发生失电子的氧化反应,即2SO32--2e-=S2O62-,故答案为:K2S2O6;2H++2e-=H2↑;2SO32--2e-=S2O62-.
点评 本题考查学生电解池的工作原理知识,借助分子式的确定为载体设计电解池的有关计算增加了试题的难度,综合性较强.

| A. | 将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性 | |
| B. | 将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 | |
| C. | 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 | |
| D. | 镁必须密封保存在容器中,防止镁跟空气中的氧气反应 |
 某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )
某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )| A. | 工作时电极b作正极,O2-由电极b流向电极a | |
| B. | 负极的电极反应式为:CO+O2--2e-═CO2 | |
| C. | 当传感器中通过2×10-3 mol电子时,通过的尾气中含有2.24 mL CO | |
| D. | 传感器中通过的电流越大,尾气中CO的含量越高 |
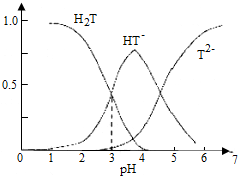
| A. | 葡萄酒中除了存在酒石酸外,还存在酒石酸盐 | |
| B. | 常温下,H2T?H++HT- Ka=10-3 | |
| C. | 当葡萄酒的pH为3.7时,HT-所占分数达到最大,此时葡萄酒中H2T>T2- | |
| D. | 当HT-和T2-物质的量浓度相等时,溶液中水电离出来的氢离子浓度小于纯水中氢离子的浓度 |
| A. | 2FeCl3+H2S═2FeCl2+2HCl+S↓ | |
| B. | 2NH4Cl+6HCl+K2Cr2O7═2KCl+N2↑+2CrCl3+7H2O | |
| C. | 3Br2+6NaOH═NaBrO3+5NaBr+3H2O | |
| D. | 5H2S+2KMnO4+3H2SO4═K2SO4+2MnSO4+5S↓+8H2O |
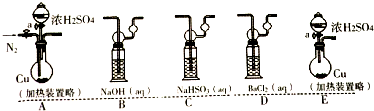
(Ⅰ)将适量纯的SO2气体通入到下列溶液中产生现象如下:
| 溶液 | ①品红溶液 | ②Na2S | ③BaCl2 | ④Ba(OH)2 | ⑤Ba(NO3)2 |
| 现象 | 溶液褪色 | 黄色沉淀 | 无明显现象 | 白色沉淀 | 白色沉淀 |
(Ⅱ)某小组探究铜与浓硫酸反应的产物.将铜与浓硫酸在烧瓶中共热时,液面上产生大量白雾,铜表面先变黑后渐渐溶解;产生的气体依次通过品红溶液和BaCl2溶液,品红溶液褪色,却意外发现BaCl2溶液也能产生白色沉淀;反应所得灰绿色溶液下沉积少量白色固体,倾倒出液体后的白色固体小心加水,溶解后溶液呈蓝色.
【查阅资料】:①Cu2S不溶于稀硫酸,能够溶于热的稀硝酸中,且产生SO42-离子.
②98.3%浓硫酸的沸点:339℃;纯硫酸温度高于500℃部分分解;
(2)对产生的气体通入使BaCl2溶液产生沉淀原因做出猜想并设计实验加以验证.
(a)若考虑装置中的空气中某成分作用于SO2使之产生沉淀,为消除这一因素,装置的选择与连接顺序为CAD;(选给定3个装置,见如图)
(b)利用所设计的装置进行实验依然发现BaCl2溶液产生沉淀,则可能的原因是浓硫酸分解生成二氧化硫和氧气,则排除此因素,装置选择和连接顺序为ACD;(给定装置,如图)
(3)探究上述实验过程中铜表面产生的黑色固体组成,某同学猜想可能为CuO或Cu2S的一种,将不溶解的表面有黑色物质附着的铜滤出、清洗、干燥、磨碎.
下列实验设计能够确认上述同学猜想的是( )
A、取少量样品加入稀硝酸加热观察是否溶解,试管口是否有气体变浅棕色;
B、取少量样品加入稀硫酸充分振荡,观察溶液是否变蓝色;
C、取少量样品加入足量稀硝酸加热溶解,加入BaCl2检验SO42-离子是否产生.
(4)取上述反应的烧瓶中残留物制备CuSO4•5H2O晶体,残留物去除不溶物后中缓缓加入适量水,溶解、蒸发浓缩、冷却结晶、过滤洗涤、干燥称重得该晶体.
| A. | 氢氧化钠溶液 | B. | 极稀的溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 水 |
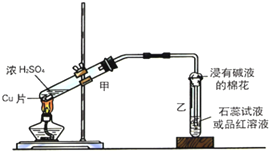 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.