题目内容
A、B、C、D、E、F为原子序数依次增大的同一短周期的主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,D元素原子次外层电子数是最外层电子数的2倍,E的气态氢化物的化学式为H2E.G元素是与以上元素既不在同一周期也不在同一主族的短周期主族元素,请回答:
(1)写出E元素在元素周期表中的位置为 .
(2)D的原子结构示意图为 .
(3)用电子式表示出B、F形成化合物的过程: .
(4)以上元素中原子半径最大的是 金属性最强的元素是 (均用元素名称回答).
(5)实验室制备G的氢化物的化学方程式: .
(6)如果向D的最高价氧化物对应水化物的钠盐溶液中滴入1-2滴酚酞,再逐滴滴入稀盐酸 ①这个过程中相应的现象是 .
②相应的化学方程式: .
(1)写出E元素在元素周期表中的位置为
(2)D的原子结构示意图为
(3)用电子式表示出B、F形成化合物的过程:
(4)以上元素中原子半径最大的是
(5)实验室制备G的氢化物的化学方程式:
(6)如果向D的最高价氧化物对应水化物的钠盐溶液中滴入1-2滴酚酞,再逐滴滴入稀盐酸 ①这个过程中相应的现象是
②相应的化学方程式:
分析:A、B、C、D、E、F为原子序数依次增大的短周期元素,A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,应是两性氢氧化物与强酸、强碱的反应,结合原子序数可知:A为Na、C为Al,三种原子最外层共有11个电子,则F的最外层电子数为11-1-3=7,则F为Cl元素;B的原子序数介于Na、Al之间,则B为Mg;D元素原子次外层电子数是最外层电子数的2倍,则D原子最外层电子数为4,故D为Si元素;E的气态氢化物的化学式为H2E,E表现-2价,处于ⅥA主族,原子序数大于Si,故E为S元素;G元素是与以上元素既不在同一周期也不在同一主族的短周期主族元素,则G为N元素,据此解答.
解答:解:A、B、C、D、E、F为原子序数依次增大的短周期元素,A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,应是两性氢氧化物与强酸、强碱的反应,结合原子序数可知:A为Na、C为Al,三种原子最外层共有11个电子,则F的最外层电子数为11-1-3=7,则F为Cl元素;B的原子序数介于Na、Al之间,则B为Mg;D元素原子次外层电子数是最外层电子数的2倍,则D原子最外层电子数为4,故D为Si元素;E的气态氢化物的化学式为H2E,E表现-2价,处于ⅥA主族,原子序数大于Si,故E为S元素;G元素是与以上元素既不在同一周期也不在同一主族的短周期主族元素,则G为N元素,
(1)E为S元素,在元素周期表中的位置为:第三周期第VIA族,
故答案为:第三周期第VIA族;
(2)D为Si元素,原子核外电子数为14,有3个电子层、最外层电子数为4,其原子结构示意图为: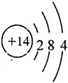 ,
,
故答案为: ;
;
(3)出B、F形成化合物为MgCl2,用电子式表示MgCl2的形成过程为: ,
,
故答案为: ;
;
(4)同周期随原子序数增大原子半径减小,电子层越多原子半径越多,以上元素中原子半径最大的是 Na;
同周期随原子序数增大金属性减弱、同主族自上而下金属性增强,故金属性最强的元素是Na,
故答案为:钠;钠;
(5)G的氢化物为NH3,实验室制备氨气的化学方程式为:2NH4Cl+Ca(OH)2
2NH3+CaCl2+2H2O,
故答案为:2NH4Cl+Ca(OH)2
2NH3+CaCl2+2H2O;
(6)Na2SiO3溶液中硅酸根水解,溶液呈碱性,向Na2SiO3溶液中滴入1-2滴酚酞,溶液呈红色,再逐滴滴入稀盐酸,发生反应Na2SiO3+2HCl═H2SiO3(胶体)+2NaCl,溶液红色逐渐消失,并有透明胶状物质生成,
故答案为:①滴入酚酞溶液显红色,再滴入盐酸红色逐渐消失,并有透明胶状物质生成;
②Na2SiO3+2HCl═H2SiO3(胶体)+2NaCl.
(1)E为S元素,在元素周期表中的位置为:第三周期第VIA族,
故答案为:第三周期第VIA族;
(2)D为Si元素,原子核外电子数为14,有3个电子层、最外层电子数为4,其原子结构示意图为:
 ,
,故答案为:
 ;
;(3)出B、F形成化合物为MgCl2,用电子式表示MgCl2的形成过程为:
 ,
,故答案为:
 ;
;(4)同周期随原子序数增大原子半径减小,电子层越多原子半径越多,以上元素中原子半径最大的是 Na;
同周期随原子序数增大金属性减弱、同主族自上而下金属性增强,故金属性最强的元素是Na,
故答案为:钠;钠;
(5)G的氢化物为NH3,实验室制备氨气的化学方程式为:2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(6)Na2SiO3溶液中硅酸根水解,溶液呈碱性,向Na2SiO3溶液中滴入1-2滴酚酞,溶液呈红色,再逐滴滴入稀盐酸,发生反应Na2SiO3+2HCl═H2SiO3(胶体)+2NaCl,溶液红色逐渐消失,并有透明胶状物质生成,
故答案为:①滴入酚酞溶液显红色,再滴入盐酸红色逐渐消失,并有透明胶状物质生成;
②Na2SiO3+2HCl═H2SiO3(胶体)+2NaCl.
点评:本题考查结构位置性质关系,侧重对常用化学用语及物质性质的考查,难度不大,注意基础知识的全面掌握.

练习册系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.