题目内容
【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 2×10-5 |
HClO | HClO | 3.0×10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.6×10-11 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是___________(填化学式)。
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为________。
(3)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是__。
A c(H+) B c(H+)c(CH3COO![]()
(4)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1_________V2(填“>”、“<”或“=”)。
(5)下列四种离子结合H+能力最强的是________。
A HCO3- B CO32- C ClO- D CH3COO-
(6)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是_________。
A Va>10Vb B Va<10Vb C Vb<10Va D Vb>10Va
(7)已知100℃时,水的离子积常数Kw=1.0×10-12,pH=3的CH3COOH和pH=9的NaOH溶液等体积混合,混合溶液呈_____________性;
(8)等浓度的①(NH4)2SO4、②NH4HSO4、③NH4HCO3、④NH4Cl、⑤NH3H2O溶液中,NH4+浓度由大到小的顺序是:_________。
(9)计算该温度下CH3COONa的水解平衡常数Kh_________。
(10)物质的量浓度相同的四种溶液:a CH3COONa、b NaHCO3、c NaClO、d Na2CO3
四种溶液的pH由小到大排列的顺序是____________(用编号填写)。
【答案】H3PO4 CO2+ClO-+H2O=HClO+HCO3- D < B A 酸性 ①>②>④>③>⑤ 5.0×10-10 a<c<b<d
【解析】
(1)酸性最强的电离平衡常数最大,酸性最弱的电离平衡常数最小;
(2)根据酸性强弱判断反应的离子方程式;
(3) 弱酸稀释,浓度降低,平衡正向移动;
(4)根据Ka判断pH值大小,再分析消耗NaOH溶液的体积;
(5)根据表格中K的数值可知H2CO3的K2最小,说明HCO3- 的酸性最弱,因此CO32-结合H+能力最强;
(6)含等量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,则有二者物质的量相等;
(7)100℃时,水的离子积常数Kw=1.0×10-12;
(8)根据同离子效应及弱碱电离情况分析;
(9)CH3COONa的水解平衡常数Kh和电离平衡常数之间存在关系:Kh=![]() ,据此计算即可;
,据此计算即可;
(10)均为强碱弱酸盐,依据阴离子水解程度分析判断。
(1)酸性最强的电离平衡常数最大,酸性最弱的电离平衡常数最小,则酸性最强的是H3PO4;
(2)向NaClO溶液中通入少量的二氧化碳,根据平衡常数K1(H2CO3)>K(HClO)>K2(H2CO3),发生反应的离子方程式为CO2+ClO-+H2O=HClO+HCO3-;
(3) A.CH3COOH溶液加水稀释过程,促进电离,c(H+)减小,选项A正确;
B.CH3COOH溶液加水稀释过程,c(CH3COOH)减小,K=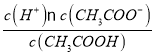 ,则
,则![]() 变小,选项B错误;
变小,选项B错误;
C.稀释过程,促进电离,c(H+)减小,c(OH-)增大,c(H+)c(OH-)=Kw,Kw不变,选项C错误;
D.稀释过程,促进电离,c(H+)减小,c(OH-)增大,则 变大,选项D正确;
变大,选项D正确;
答案选D;
(4)根据HClO的Ka=3.0![]() 10-8 < CH3COOH的Ka=2.0
10-8 < CH3COOH的Ka=2.0![]() 10-5,醋酸酸性强于次氯酸,相同温度下,相同pH值的醋酸和次氯酸溶液,次氯酸浓度大,中和相同体积、相同浓度的NaOH溶液,酸性强的浓度小,消耗的量少,所以V1<V2;
10-5,醋酸酸性强于次氯酸,相同温度下,相同pH值的醋酸和次氯酸溶液,次氯酸浓度大,中和相同体积、相同浓度的NaOH溶液,酸性强的浓度小,消耗的量少,所以V1<V2;
(5)根据表格中K的数值可知H2CO3的K2最小,说明HCO3- 的酸性最弱,因此CO32-结合H+能力最强;
答案选B;
(6)含等量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,则有二者物质的量相等,因为所中和的氢氧化钠的物质的量是一定的,而醋酸是弱酸,醋酸为弱电解质,浓度越大,电离程度越小,pH为2和3的CH3COOH溶液,后者电离程度大,pH为2的CH3COOH的浓度大于pH为3的CH3COOH溶液的浓度的10倍,设pH为2的醋酸浓度为x,pH=3的醋酸浓度为y,则有Va×x=Vb×y,则,即Vb>10Va;
答案选A;
(7)100℃时,水的离子积常数Kw=1.0×10-12,pH=3的CH3COOH中 c(CH3COOH)>c(H+)=10-3mol/L,pH=9的NaOH溶液中c(NaOH)=c(OH-)=10-3mol/L,等体积混合酸过量,溶液呈酸性;
(8)⑤NH3H2O溶液中c(NH
②NH4HSO4、③NH4HCO3、④NH4Cl中铵根离子系数都是1,碳酸氢根离子促进铵根离子水解,氢离子抑制铵根离子水解,三者c(NH4+)浓度②>④>③;
①(NH4)2SO4中铵根离子系数都是2,其溶液中铵根离子浓度大于其余溶液中铵根离子浓度;则溶液中铵根离子浓度从小到大顺序是①>②>④>③>⑤;
(9)醋酸的电离常数Ka=2×10-5mol/L,CH3COONa的水解平衡常数Kh=![]() =
=![]() =5.0×10-10;
=5.0×10-10;
(10) 已知酸性大小为:CH3COOH>H2CO3>HClO>HCO3->CO32-,所以水解程度:Na2CO3>NaHCO3>NaClO>CH3COONa,则物质的量浓度相同的四种溶液,pH由小到大排列的顺序是a<c<b<d。

【题目】钼酸钠(Na2MoO4)是一种重要的化工原料。用废加氢催化剂(含有MoS2和Al2O3、Fe2O3、SiO2等)为原料制取钼酸钠,工艺流程如图所示:

已知:MoO3、A12O3在高温下能跟Na2CO3发生反应。
回答下列问题:
(1)Na2MoO4中Mo元素的化合价______。
(2)废加氢催化剂焙烧目的是脱除表面油脂、硫等。请根据表中实验数据分析,废加氢催化剂预处理温度应选择______℃。
废催化剂在不同温度下的烧残(时间:2h)
温度 /℃ | 300 | 350 | 400 | 500 | 600 |
烧前 /g | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 |
烧后 /g | 48.09 | 47.48 | 47.19 | 46.55 | 46.52 |
烧残, % | 96.2 | 95.0 | 94.4 | 93.1 | 93.0 |
(3)焙烧时生成MoO3的化学方程式为______,当生成1mol MoO3转移电子数为______NA。
(4)加碳酸钠碱性焙烧时主要反应的化学方程式为______。
(5)用50t含MoS2为80%的废加氢催化剂,经过制取、分离、提纯,得到30.9t Na2MoO4,则Na2MoO4的产率为______。
【题目】如图是元素周期表的一部分:
数据编号 | 滴入NaOH溶液的体积 | 溶液的pH | |
HX | HZ | ||
1 | 0 | 3 | 1 |
2 |
| a | b |
![]() 时,用浓度为
时,用浓度为![]() 的氢氧化钠溶液分别滴定
的氢氧化钠溶液分别滴定![]() 浓度均为
浓度均为![]() 的两种酸HX、
的两种酸HX、![]() 忽略体积变化
忽略体积变化![]() ,实验数据如表2,下列判断正确的是
,实验数据如表2,下列判断正确的是![]()
A.通过分析可得表格中![]() ,
,![]()
B.将上述的HZ溶液稀释100倍后pH比HX溶液的pH大
C.由于Z元素的非金属性比Y强,所以Z氢化物的酸性较强
D.![]()
![]()
![]() 的水溶液中:
的水溶液中:![]()
![]()
【题目】甲醇是重要的化学工业基础原料和清洁液体燃料。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=______(用K1、K2表示)。
(2)反应③的ΔH____0(填“>”或“<”)。
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度相等,且均为0.1mol·L-1,则此时υ正____υ逆(填“>”、“=”或“<”)
(4)某温度下在2L恒容密闭容器中加入CH3OH发生反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g),测得有关数据如下:
CH3OCH3(g)+H2O(g),测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.42 | 0.22 | 0.02 | 0.02 |
①反应在2min内以CH3OCH3表示的化学反应速率为____,
②该温度下的反应的平衡常数为____。

