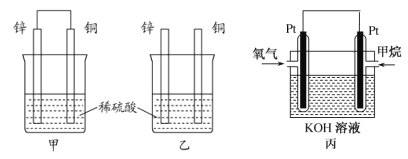
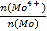题目内容
【题目】甲醇是重要的化学工业基础原料和清洁液体燃料。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=______(用K1、K2表示)。
(2)反应③的ΔH____0(填“>”或“<”)。
(3)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度相等,且均为0.1mol·L-1,则此时υ正____υ逆(填“>”、“=”或“<”)
(4)某温度下在2L恒容密闭容器中加入CH3OH发生反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g),测得有关数据如下:
CH3OCH3(g)+H2O(g),测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.42 | 0.22 | 0.02 | 0.02 |
①反应在2min内以CH3OCH3表示的化学反应速率为____,
②该温度下的反应的平衡常数为____。
【答案】K1×K2 < < 0.10mol/(Lmin) 625
【解析】
(1)根据反应①与②的平衡常数表达式推导出反应③的平衡常数表达式,导出K1、K2与K3之间的关系;
(2)计算出不同温度下的K3,找到变化规律进行判断;
(3)通过Qc与K3之间的大小关系进行判断;
(4)①根据υ=![]() 计算反应速率;
计算反应速率;
②利用三段法进行计算。
(1)K1=![]() ,K2=
,K2=![]() ,K3=
,K3=![]() ,则有K3=K1×K2
,则有K3=K1×K2
(2)500℃时,K3=2.5,800℃时,K3=0.375,温度升高,平衡常数减小,可知正反应为放热反应,ΔH<0;
(3)500℃时,Qc=![]() =100>K3,反应逆向进行,即υ正<υ逆;
=100>K3,反应逆向进行,即υ正<υ逆;
(4)①υ(CH3OH)=![]() =
=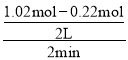 =0.2 mol/(Lmin),υ(CH3OCH3)=
=0.2 mol/(Lmin),υ(CH3OCH3)=![]() υ(CH3OH)= 0.1 mol/(Lmin);
υ(CH3OH)= 0.1 mol/(Lmin);
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
始(mol/L) 0.51 0 0
转(mol/L) 0.5 0.25 0.25
平(mol/L) 0.01 0.25 0.25
平衡常数K=![]() =
=![]() =625。
=625。

 阅读快车系列答案
阅读快车系列答案【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:
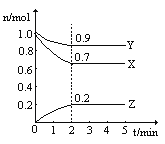
(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.36 | 0.48 | 0.50 | 0.50 |
0~50s内的平均反应速率v(N2)=__________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。