题目内容
【题目】汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。
(1)汽车内燃机工作时发生反应:N2(g) + O2(g)![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol。
① 5 min内该反应的平均速率υ(NO) = ;在T ℃时,该反应的平衡常数K = 。
② 反应开始至达到平衡的过程中,容器中下列各项发生变化的是 (填序号)。
a. 混合气体的密度 b. 混合气体的压强
c. 正反应速率 d. 单位时间内,N2和NO的消耗量之比
(2)H2或CO可以催化还原NO以达到消除污染的目的。
已知:N2(g) + O2(g) = 2NO(g) H=" +180.5" kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) H= -571.6 kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是 。
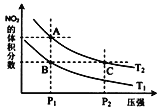
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应:2NO(g) + 2CO(g)![]() 2CO2(g) + N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
① 该反应的H 0 (填“>”或“<”)。
② 若催化剂的表面积S1>S2 ,在下图中画出c(NO) 在T1、S2 条件下达到平衡过程中的变化曲线。
【答案】(9分)
(1)① 0.2 mol·L-1·min-1(1分) 1.25(1分) ② c d(2分)
(2)2H2(g) + 2NO(g) = N2(g) + 2H2O(l) ΔH = -752.1 kJ·mol-1 (2分)
(3)① <(1分)
②
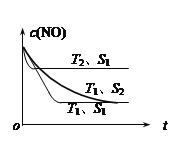 (2分)
(2分)
【解析】
试题(1)①根据“三段式”进行计算:N2(g) + O2(g)![]() 2NO(g)
2NO(g)
开始(mol/L) 6.5 7.5 0
变化(mol/L) 2.5 2.5 5
平衡(mol/L) 4 5 5
5 min内该反应的平均速率υ (NO) = 5mol÷5L÷5min=0.2 mol·L-1·min-1;把平衡时各物质物质的量转化为物质的量浓度,可得平衡常数K =12÷(0.8×1)=1.25。
②a、根据质量守恒定律,气体的质量不变,体积恒定,所以混合气体的密度为定值,不发生变化;b、该反应前后气体系数相等,所以压强定值,不发生变化;c、反应开始至达到平衡的过程中,正反应速率逐渐减小,正确;d、在达到化学平衡前,正反应速率大于逆反应速率,所以单位时间内,N2和NO的消耗量之比逐渐减小,正确。
(2)首先写出H2与NO反应的化学方程式并注明状态,然后根据盖斯定律求焓变,H=H1—H2=-752.1 kJ·mol-1,可写出热化学方程式。
(3)①根据图像可知,T2反应速率快,则T1< T2,T2时NO的浓度增大,平衡向逆反应方向移动,所以正反应为放热反应,H < 0。
②催化剂的表面积S1>S2 ,S1时反应速率大于S2 时反应速率,催化剂不影响化学平衡,平衡时c(NO)的浓度相同,可画出T1、 S2 条件下达到平衡过程中的变化曲线。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 2×10-5 |
HClO | HClO | 3.0×10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.6×10-11 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是___________(填化学式)。
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为________。
(3)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是__。
A c(H+) B c(H+)c(CH3COO![]()
(4)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1_________V2(填“>”、“<”或“=”)。
(5)下列四种离子结合H+能力最强的是________。
A HCO3- B CO32- C ClO- D CH3COO-
(6)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是_________。
A Va>10Vb B Va<10Vb C Vb<10Va D Vb>10Va
(7)已知100℃时,水的离子积常数Kw=1.0×10-12,pH=3的CH3COOH和pH=9的NaOH溶液等体积混合,混合溶液呈_____________性;
(8)等浓度的①(NH4)2SO4、②NH4HSO4、③NH4HCO3、④NH4Cl、⑤NH3H2O溶液中,NH4+浓度由大到小的顺序是:_________。
(9)计算该温度下CH3COONa的水解平衡常数Kh_________。
(10)物质的量浓度相同的四种溶液:a CH3COONa、b NaHCO3、c NaClO、d Na2CO3
四种溶液的pH由小到大排列的顺序是____________(用编号填写)。
【题目】已知:H2(g)+I2(g)![]() 2HI(g);ΔH= -14.9kJ·mol-1。某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的
2HI(g);ΔH= -14.9kJ·mol-1。某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的
起始浓度 | c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)(mol·L-1) |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25