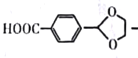
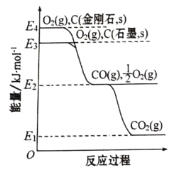
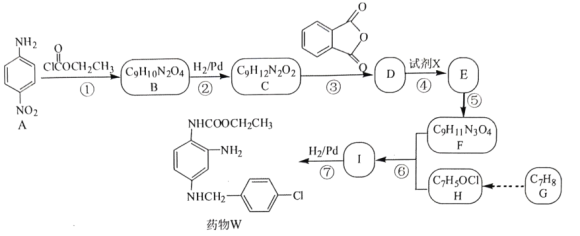
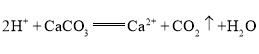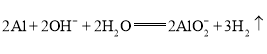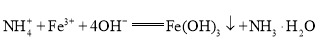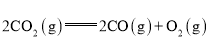题目内容
【题目】200mL Fe2(SO4)3溶液中含Fe3+56g,在该溶液中加入1mol/LBaCl2溶液300mL,反应后溶液中SO42-的物质的量浓度是(忽略混合后溶液的体积变化) ( )
A.7.5mol/LB.5mol/LC.6mol/LD.2.4mol/L
【答案】D
【解析】
200mL Fe2(SO4)3溶液中Fe3+为56g,物质的量为![]() =1mol,根据电荷守恒可知,溶液中n(SO42-)=
=1mol,根据电荷守恒可知,溶液中n(SO42-)=![]() n(Fe3+)=
n(Fe3+)=![]() ×1mol=1.5mol,加入的BaCl2的物质的量为1mol/L×0.3L=0.3mol,故n(Ba2+)=0.3mol,根据SO42-+Ba2+═BaSO4↓可知,剩余SO42-的物质的量为1.5mol-0.3mol=1.2mol,所以反应后溶液中SO42-的物质的量的浓度为
×1mol=1.5mol,加入的BaCl2的物质的量为1mol/L×0.3L=0.3mol,故n(Ba2+)=0.3mol,根据SO42-+Ba2+═BaSO4↓可知,剩余SO42-的物质的量为1.5mol-0.3mol=1.2mol,所以反应后溶液中SO42-的物质的量的浓度为![]() =2.4mol/L,故选D。
=2.4mol/L,故选D。

【题目】(1)乙醇的分子式是C2H6O。由于有机物普遍存在同分异构现象,其结构简式可能为:

为确定其结构,应利用物质的特殊性质进行定性、定量实验。现给出乙醇、钠及必要的仪器,请同学直接利用如图给定装置开始进行实验确定乙醇的结构。

某同学得到一组实验数据:
乙醇的物质的量(mol) | 氢气的体积(L) |
0.10 | 1.12(标准状况) |
根据以上数据判断乙醇的结构是为____(I、II),理由为____。
(2)某实验小组用下列装置进行乙醇催化氧化的实验。

①实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式_____、____。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是____反应。
②甲和乙两个水浴作用不相同。甲的作用是___;乙的作用是_____。
③反应进行一段时间后,干燥管a中能收集到不同的物质,它们是___。集气瓶中收集到的气体的主要成分是___。
④若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有___。要除去该物质,可在混合液中加入___(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过____(填实验操作名称)即可除去。
【题目】测定硫酸铜晶体(CuSO4xH2O)中x值的实验过程如下:

完成下列填空:
(1)必须要进行恒重操作的原因是___。
(2)下面是某同学的一次实验记录,请完成下表。
称量数据1 | 称量数据2 | 称量数据3 | 结晶水的X值 | 实验误差 |
11.685g | 13.691g | 12.960g | ____ | ____ |
(3)本次实验测得X值偏__(高、低),可能这次实验中产生误差的原因可能是___。
A.硫酸铜晶体中含有不挥发性杂质 B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却