��Ŀ����
����Ŀ��ij�о�С���Է����廯����AΪ��Ҫԭ�ϣ���������·�ϳɿ����ҩ��W��

��֪��![]()
��ش�
��1������˵����ȷ����________��
A.��Ӧ����������Ӧ B.�Լ�X��Ũ�����Ũ����
C.��Ӧ�ۢݵ�Ŀ���DZ���![]() D.ҩ��W�ķ���ʽ��
D.ҩ��W�ķ���ʽ��![]()
��2��д��������C�Ľṹ��ʽ________��
��3��д����Ӧ�Ļ�ѧ����ʽ________��
��4����ƴ�G��H�ĺϳ�·�ߣ�������ͼ��ʾ�����Լ���ѡ��________��
��5��д��������A������ͬϵ��Y��ͬ���칹��ṹ��ʽ���ұ����������������________��
���ܷ���������Ӧ��
��![]() �����������й���4��Hԭ�ӣ�
�����������й���4��Hԭ�ӣ�
�۳��˱�������������
���𰸡�BC 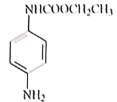
 +H2O
+H2O 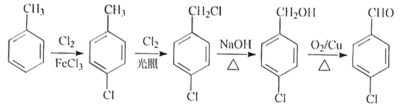
��������
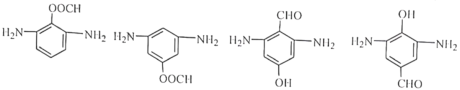
��ҩ��W�Ľṹ��ʽ��H�ķ���ʽ��֪HΪ![]() ���������֪����ҩ��W�Ľṹ��ʽ��F�ķ���ʽ��֪FΪ
���������֪����ҩ��W�Ľṹ��ʽ��F�ķ���ʽ��֪FΪ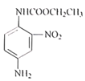 ��IΪ
��IΪ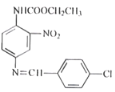 �����ҩ��W��B�ķ���ʽ�ɵó�BΪ
�����ҩ��W��B�ķ���ʽ�ɵó�BΪ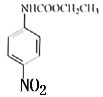 ���Ա�B��C�ķ���ʽ��֪CΪ
���Ա�B��C�ķ���ʽ��֪CΪ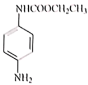 ���������֪���ɵó�DΪ
���������֪���ɵó�DΪ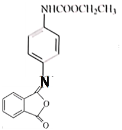 ���Ա�F��֪EΪ
���Ա�F��֪EΪ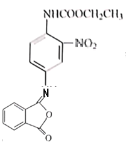 ���ݴ˽��
���ݴ˽��
(1)A����Ӧ���У�B( )��ΪC(
)��ΪC(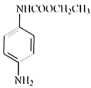 )����HȥO����ԭ��Ӧ��A����
)����HȥO����ԭ��Ӧ��A����
B��D��E����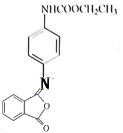 ���Լ�X�õ�
���Լ�X�õ�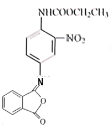 ������������Ӧ���Լ�X��Ũ�����Ũ���ᣬB��ȷ��
������������Ӧ���Լ�X��Ũ�����Ũ���ᣬB��ȷ��
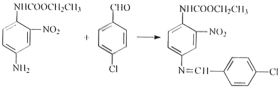
C���۵ķ�Ӧ��C�͢ݵ�������F������ͬ��![]() ��˵����Ӧ�ۢݵ�Ŀ���DZ���
��˵����Ӧ�ۢݵ�Ŀ���DZ���![]() ��C��ȷ��
��C��ȷ��
D��ҩ��W�ķ���ʽ��![]() ��D����
��D����
�ʴ�Ϊ��BC��
(2)�ɷ�����֪��C�Ľṹ��ʽΪ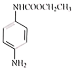 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(3)��Ӧ����������֪�����Ƶķ�Ӧ����ѧ����ʽΪ��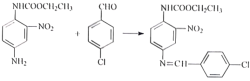 +H2O���ʴ�Ϊ��
+H2O���ʴ�Ϊ�� +H2O��
+H2O��
(4)GΪ![]() ��HΪ
��HΪ![]() ��G��H�ɰ����·�ʽ�ϳɣ�
��G��H�ɰ����·�ʽ�ϳɣ�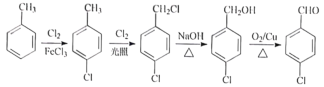 ���ʴ�Ϊ��
���ʴ�Ϊ��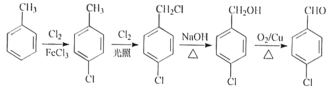 ��
��
(5)AΪ![]() ��YΪA������ͬϵ���Y��A��һ��CH2���ܷ���������Ӧ��������������ٺ���-CHO����������3��������Nԭ��2������2��������Oԭ��1����H��ɣ���Ч����4�֣���ȥȩ���ϵ�H�⣬ֻ����3�ֵ�Ч�⣬��ṹ�Գƣ�������������2�֣�
��YΪA������ͬϵ���Y��A��һ��CH2���ܷ���������Ӧ��������������ٺ���-CHO����������3��������Nԭ��2������2��������Oԭ��1����H��ɣ���Ч����4�֣���ȥȩ���ϵ�H�⣬ֻ����3�ֵ�Ч�⣬��ṹ�Գƣ�������������2�֣�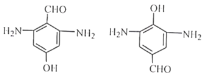 ���ں���HCOO-��2��-NH2��������������������2�֣�
���ں���HCOO-��2��-NH2��������������������2�֣�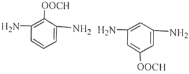 ���ۺ�
���ۺ�![]() ��-O-��-NH2��������
��-O-��-NH2��������![]() ��-NH2����2��H��û�з���4�ֵ�Ч��Ľṹ����������������4�ֽṹ������������
��-NH2����2��H��û�з���4�ֵ�Ч��Ľṹ����������������4�ֽṹ������������ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��

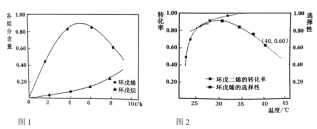
����Ŀ����Ǧ�̳�����Ҫ�ɷ�ΪǦ��������(Pb2O3��Pb3O4��PbO)��PbSO4����������ҪΪ����(Cd)��������մ�����Ǧ�̳���ʵ����Դ������ij����������ͼ��
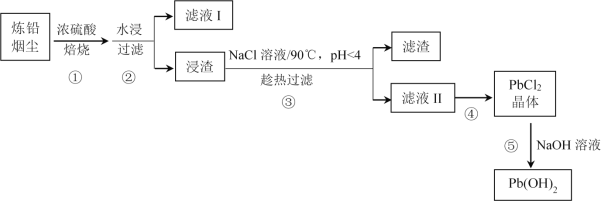
��֪����.Pb2O3![]() Pb3O4
Pb3O4![]() PbO
PbO
��.CdSO4������ˮ�����ȶ��Ժ�
��.PbSO4(s)+2Cl-(aq)![]() PbCl2(s)+SO42-(aq)
PbCl2(s)+SO42-(aq)
PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)
PbCl42-(aq)
��.Pb(OH)2������������
(1)������б��յ�Ŀ����________���ڴ˹�����PbO��Ũ���ᷢ����Ӧ�Ļ�ѧ����ʽΪ________��
(2)��ҺI�ijɷ���________��
(3)��ͬ��Ӧʱ�䣬������б����¶Ⱥ����ϱȶ�Pb��Cdȥ���ʵ�Ӱ�����±���ʾ����δ�ﵽƽ��״̬����
�����¶�/�� | ��Ԫ�ص�ȥ����/% | ���ϱ�/(mL/g) | ��Ԫ�ص�ȥ����/% | ||
Pb | Cd | Pb | Cd | ||
100 | 2.57 | 56.63 | 0.3 | 2.57 | 74.12 |
200 | 2.62 | 89.30 | 0.4 | 2.67 | 85.10 |
500 | 2.67 | 96.98 | 0.5 | 2.72 | 92.48 |
600 | 2.87 | 95.42 | 0.6 | 2.67 | 96.98 |
900 | 2.88 | 40.15 | 0.7 | 2.65 | 95.13 |
Ӧѡ��ı����¶Ⱥ����ϱ�Ϊ________��
Cdȥ�������¶�������������С��ԭ�����Ϊ________��
(4)�������NaCl��Һ��������________��
(5)����ܵIJ�����________��
(6)����˵����ȷ����________(�����)��
A.�������Ũ������������
B.�������pH<4��Ŀ���Ƿ�ֹPb2+ˮ��
C.����ܵ���Һ��ѭ�����������Pb�Ļ�����
D.�����������NaOH��ҺŨ�ȿ�ʹPb������ȫ
����Ŀ�����ͻ���β����![]() ����ȫ��Χ���ܹ�ע���ȵ����⡣
����ȫ��Χ���ܹ�ע���ȵ����⡣
(1)���ͻ���β���е�![]() �ǿ����е�
�ǿ����е�![]() �ڸ�����ȼ�����ɵģ������ɵķ�Ӧ�������£�
�ڸ�����ȼ�����ɵģ������ɵķ�Ӧ�������£�
A22A��
A+B2NO+B��
B��+A2NO+A��
��֪![]() ʱ�ļ������ݣ�
ʱ�ļ������ݣ�
��ѧ�� | O=O | N��N | N=O |
����/kJ��mol-1 | 498.0 | 946.0 | 630.0 |
������������![]() ��������________(����
��������________(����![]() ������
������![]() ��)���������жϵ�ԭ����________��
��)���������жϵ�ԭ����________��
�ڸ�������![]() �����ɻ�������д��ͨ��״����
�����ɻ�������д��ͨ��״����![]() ȼ������
ȼ������![]() ���Ȼ�ѧ����ʽ��________��
���Ȼ�ѧ����ʽ��________��
(2)TWC����������ȼ�ϲ���ȫȼ�����ɵ�![]() ��β���е�
��β���е�![]() ��ԭΪ������ļ������� 2NO+2CO
��ԭΪ������ļ������� 2NO+2CO![]() 2CO2+N2 ��H��0���ֽ���COa%(�����������ͬ)��NO0.30%��ģ������β����100mL��min-1������ͨ��450��ķ�Ӧ��������������CO�ĺ�����Ϊb%(��������仯���Բ���)����v(CO)=________mL��min-1��������Ӧ���¶Ƚ�����350�棬����������CO�ĺ���________b%(������������������=��)
2CO2+N2 ��H��0���ֽ���COa%(�����������ͬ)��NO0.30%��ģ������β����100mL��min-1������ͨ��450��ķ�Ӧ��������������CO�ĺ�����Ϊb%(��������仯���Բ���)����v(CO)=________mL��min-1��������Ӧ���¶Ƚ�����350�棬����������CO�ĺ���________b%(������������������=��)
(3)SCR����������![]() ��β���е�
��β���е�![]() ѡ���Ի�ԭΪ������ļ���������
ѡ���Ի�ԭΪ������ļ���������![]() ��ͨ������[CO(NH2)2]�ֽ����ɵģ�
��ͨ������[CO(NH2)2]�ֽ����ɵģ�
��.CO(NH2)2(s)NH3(g)+HNCO(g) H1
��.HNCO(g)+H2O(g)NH3(g)+CO2(g) H2
��һ���¶��£���һ�����ܱ�������Ͷ��������CO(NH2)2�����һ������ˮ����������������Ӧ������Ӧ�ﵽƽ��ʱ�����c(NH3)=pmol/L��c(HNCO)=qmol/L����Ӧ���ƽ�ⳣ��Ϊ________(�ú�p��q�ı���ʽ��ʾ����ͬ)��c(CO2)=________mol/L��
���ҹ���ѧ�����о��¶ȡ�����Ũ�ȶ�����ˮ�����Ũ�ȵ�Ӱ��õ��������ݣ�
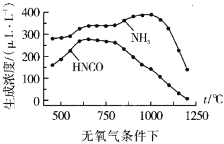
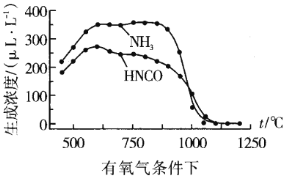
ͨ�����ݶԱȿ��Է�������������1100������ʱ����ϵ��![]() Ũ�Ƚӽ�0��LL-1�������ԭ��__
Ũ�Ƚӽ�0��LL-1�������ԭ��__