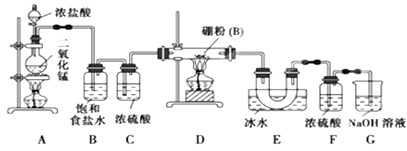
题目内容
【题目】在不同温度下,水溶液中pH和pOH的关系如图所示,已知pH=-lgc(H+),pOH=-lgc(OH-)。下列说法一定正确的是( )

A.水的电离程度,B>A>D
B.lmolL-1Na2SO4溶液不可能处于B点
C.向C点水溶液中通入HCl,则C点变为E点
D.0.1molL-1NaHA溶液的pH和pOH的关系如图中E点所示,此时溶液中离子的物质的量浓度关系:c(HA-)>c(A2-)>c(H2A)
【答案】D
【解析】
如图: ,由Kw=c(H+)×c(OH-)得,Kw=10-pH×10-pOH,由此可知,曲线2的Kw大于曲线1的Kw,那么曲线2的温度高于曲线1的温度。
,由Kw=c(H+)×c(OH-)得,Kw=10-pH×10-pOH,由此可知,曲线2的Kw大于曲线1的Kw,那么曲线2的温度高于曲线1的温度。
A点:pH=pOH,则-lgc(H+)=-lgc(OH-),可得c(H+)=c(OH-),溶液显中性;同理,B点:pH=pOH,溶液显中性;C、D点:pH>pOH,-lgc(H+)>-lgc(OH-),可得c(H+)<c(OH-),溶液显碱性;E点:pH<pOH,溶液显酸性,据此解答。
A.B点的pH、pOH均小于A点,则B点的Kw大于A的点Kw,那么B点温度高于A点的温度,A、B、D点溶液若不涉及盐类水解,则水的电离程度:B>A>D,若涉及盐类水解,则无法判断,A错误;
B.Na2SO4溶液呈中性,由分析可知,B点显中性溶液,即lmolL-1Na2SO4溶液可能处于B点,B错误;
C.C点和E点所处温度不同,水的离子积Kw不同,所以通入HCl,则C点不能变为E点,C错误;
D.E点溶液显酸性,则NaHA溶液中,HA-的电离(HA-![]() H++A2-)程度大于水解(HA-+H2O
H++A2-)程度大于水解(HA-+H2O![]() H2A+OH-)程度,那么c(A2-)>c(H2A),电离和水解均很微弱,c(HA-)最大,故c(HA-)>c(A2-)>c(H2A),D正确。
H2A+OH-)程度,那么c(A2-)>c(H2A),电离和水解均很微弱,c(HA-)最大,故c(HA-)>c(A2-)>c(H2A),D正确。
答案选D。