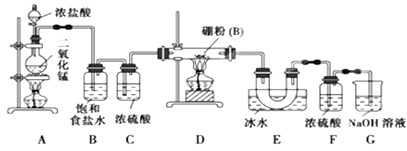
题目内容
【题目】测定硫酸铜晶体(CuSO4xH2O)中x值的实验过程如下:

完成下列填空:
(1)必须要进行恒重操作的原因是___。
(2)下面是某同学的一次实验记录,请完成下表。
称量数据1 | 称量数据2 | 称量数据3 | 结晶水的X值 | 实验误差 |
11.685g | 13.691g | 12.960g | ____ | ____ |
(3)本次实验测得X值偏__(高、低),可能这次实验中产生误差的原因可能是___。
A.硫酸铜晶体中含有不挥发性杂质 B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却
【答案】确保完全失去结晶水 5.096 1.92% 高 BC
【解析】
(1)确保完全失去结晶水,要求2次称量硫酸铜固体质量差小于0.001g;
(2)通过方程式CuSO4xH2O![]() CuSO4+xH2O计算;
CuSO4+xH2O计算;
(3)本次实验测得X值偏高;
(1)确保完全失去结晶水,要求2次称量硫酸铜固体质量差小于0.001g;
(2)m(CuSO4xH2O)=13.691g-11.685g=2.006g,m(H2O)=13.691g-12.960g=0.731g,
CuSO4xH2O![]() CuSO4+xH2O
CuSO4+xH2O
160+18x 18x
2.006 0.731
(160+18x):18x=2.006:0.731,化简求解,x=5.096;(5.096-5)/5×100%=1.92%;
(3)本次实验测得X值偏高;
A.硫酸铜晶体中含有不挥发性杂质,结晶水的质量偏小,则x偏低,与题意不符,A错误;
B.实验前晶体表面有湿存水,导致结晶水的质量偏大,则x偏高,符合题意,B正确;
C.加热时有晶体飞溅出去,导致结晶水的质量偏大,则x偏高,符合题意,C正确;
D.加热失水后露置在空气中冷却,结晶水的质量偏小,则x偏低,与题意不符,D错误;
答案为BC。

 优等生题库系列答案
优等生题库系列答案【题目】炼铅烟尘的主要成分为铅的氧化物(Pb2O3、Pb3O4、PbO)及PbSO4,其杂质主要为含镉(Cd)化合物,回收处理炼铅烟尘可实现资源再生。某工艺流程如图:
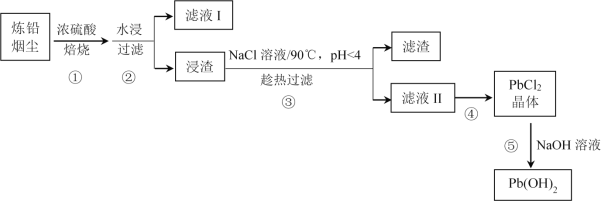
已知:ⅰ.Pb2O3![]() Pb3O4
Pb3O4![]() PbO
PbO
ⅱ.CdSO4易溶于水,热稳定性好
ⅲ.PbSO4(s)+2Cl-(aq)![]() PbCl2(s)+SO42-(aq)
PbCl2(s)+SO42-(aq)
PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)
PbCl42-(aq)
ⅳ.Pb(OH)2为两性氢氧化物
(1)步骤①中焙烧的目的是________。在此过程中PbO与浓硫酸发生反应的化学方程式为________。
(2)滤液I的成分是________。
(3)相同反应时间,步骤①中焙烧温度和酸料比对Pb、Cd去除率的影响如下表所示(均未达到平衡状态)。
焙烧温度/℃ | 各元素的去除率/% | 酸料比/(mL/g) | 各元素的去除率/% | ||
Pb | Cd | Pb | Cd | ||
100 | 2.57 | 56.63 | 0.3 | 2.57 | 74.12 |
200 | 2.62 | 89.30 | 0.4 | 2.67 | 85.10 |
500 | 2.67 | 96.98 | 0.5 | 2.72 | 92.48 |
600 | 2.87 | 95.42 | 0.6 | 2.67 | 96.98 |
900 | 2.88 | 40.15 | 0.7 | 2.65 | 95.13 |
应选择的焙烧温度和酸料比为________。
Cd去除率随温度升高先增大后减小的原因可能为________。
(4)步骤③中NaCl溶液的作用是________。
(5)步骤④的操作是________。
(6)下列说法正确的是________(填序号)。
A.步骤①中浓硫酸作氧化剂
B.步骤③中pH<4的目的是防止Pb2+水解
C.步骤④的滤液可循环利用以提高Pb的回收率
D.步骤⑤中增大NaOH溶液浓度可使Pb沉淀完全