题目内容
【题目】(1)乙醇的分子式是C2H6O。由于有机物普遍存在同分异构现象,其结构简式可能为:
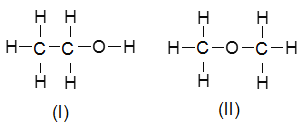
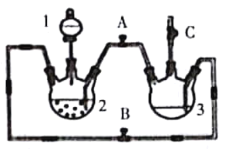
为确定其结构,应利用物质的特殊性质进行定性、定量实验。现给出乙醇、钠及必要的仪器,请同学直接利用如图给定装置开始进行实验确定乙醇的结构。

某同学得到一组实验数据:
乙醇的物质的量(mol) | 氢气的体积(L) |
0.10 | 1.12(标准状况) |
根据以上数据判断乙醇的结构是为____(I、II),理由为____。
(2)某实验小组用下列装置进行乙醇催化氧化的实验。

①实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式_____、____。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是____反应。
②甲和乙两个水浴作用不相同。甲的作用是___;乙的作用是_____。
③反应进行一段时间后,干燥管a中能收集到不同的物质,它们是___。集气瓶中收集到的气体的主要成分是___。
④若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有___。要除去该物质,可在混合液中加入___(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过____(填实验操作名称)即可除去。
【答案】I 乙醇和氢气物质的量比是2:1 2Cu+O2![]() 2CuO,CuO+CH3CH2OH
2CuO,CuO+CH3CH2OH![]() CH3CHO+Cu+H2O 放热 热水浴,促进乙醇挥发 冷水浴 冷凝作用 乙醛、乙醇 N2 乙酸 c 蒸馏
CH3CHO+Cu+H2O 放热 热水浴,促进乙醇挥发 冷水浴 冷凝作用 乙醛、乙醇 N2 乙酸 c 蒸馏
【解析】
(1)根据乙醇和氢气的比例关系分析乙醇的结构。
(2)根据铜和氧气的反应、氧化铜和乙醇的反应分析方程式,根据反应进行后不需要加热即可维持说明该反应为放热反应。
(3)根据乙醇液体通过水浴加热变成气体,与灼热的铜反应生成乙醛和水,通过冷却将产物收集在试管a处,剩余的氮气最后用排水法进行收集。
(1).氢气的物质的量为0.05mol,说明乙醇和氢气的比例关系为2:1,则乙醇中一种一个氢原子可以和钠反应,与其他的5个氢原子不同,故结构为 I;
(2) ①铜在加热情况下与氧气反应生成氧化铜,方程式为:. 2Cu+O2![]() 2CuO,氧化铜和乙醇反应生成乙醛、铜和水,方程式为:CuO+CH3CH2OH
2CuO,氧化铜和乙醇反应生成乙醛、铜和水,方程式为:CuO+CH3CH2OH![]() CH3CHO+Cu+H2O ;熄灭酒精灯反应仍在进行,说明该反应为放热反应;
CH3CHO+Cu+H2O ;熄灭酒精灯反应仍在进行,说明该反应为放热反应;
②甲是热水浴,促进乙醇挥发,提供乙醇气体,乙为冷水浴,起冷凝作用,使反应产物乙醛冷却为液体,乙醇也冷却为液体;
③冷却后得到的液体含有乙醛、乙醇,剩余的气体为N2;
④若收集到的物质能使石蕊变红,说明含有酸性物质,即为乙酸;乙酸能和碳酸氢钠溶液反应,故选c;
乙醛和乙醇属于互溶的液体混合物,用蒸馏方法分离。