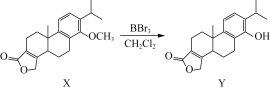
题目内容
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.用浓盐酸分别和MnO2、KClO3反应制备1 mol氯气,转移的电子数均为2NA
B.0.1 mol·L-1 NaF溶液中所含F-的数目小于0.1NA
C.用1 L 1 mol·L-1 FeCl3溶液充分反应制备氢氧化铁胶体,该体系中含氢氧化铁胶体粒子数目为1NA
D.标准状况下,4.48 L CO2和N2O的混合气体中含有的电子数为4.4NA
【答案】D
【解析】
A.浓盐酸和二氧化锰制取氯气方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,当生成1 molCl2时,转移的电子数为2NA;浓盐酸和氯酸钾制取氯气的方程式为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,当生成1 molCl2时,转移的电子数为
MnCl2+Cl2↑+2H2O,当生成1 molCl2时,转移的电子数为2NA;浓盐酸和氯酸钾制取氯气的方程式为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,当生成1 molCl2时,转移的电子数为![]() NA,故A错误;
NA,故A错误;
B.溶液体积未知,无法计算溶液中微粒数目,故B错误;
C.一个胶粒子是多个氢氧化铁的聚集体,所以胶体粒子的数目小于NA,故C错误;
D.标况下4.48 L CO2和N2O的混合气体的物质的量为0.2mol,一个CO2分子含电子数为22,一个N2O含电子数也为22,所以0.2mol混合物含电子4.4mol,故D正确;
故答案为D。

【题目】现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
为鉴别它们,分别完成一些实验。请根据实验的结果回答下列问题:
(1)A溶液与B溶液反应可生成气体X。根据上述六种离子之间的可能反应判断X的化学式为 ,A溶液与B溶液反应的离子方程式为 。
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为 ,B溶于水后的电离方程式为 。
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E。B溶液与C溶液反应至中性的离子方程式为 。
(4)D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为bL,则求算E在混合物中的质量分数的表达式为 。