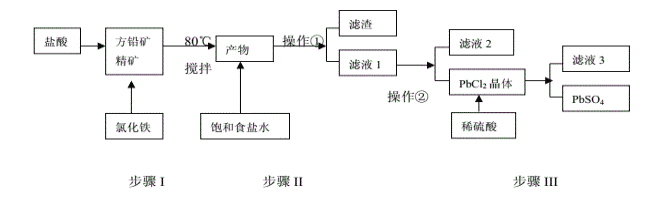
题目内容
【题目】把 NaOH、MgCl2、AlCl3 三种固体组成的混合物溶于足量水后,产生 1.16g 白色沉淀, 再向所得浊液中逐渐加入 2.00mol/LHCl 溶液,加入HCl 溶液的体积与生成沉淀的关系如图所示。
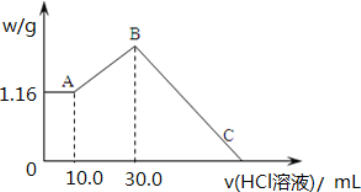
(1)A 点沉淀物的化学式为_____。B 点纵坐标为___________________。
(2)A 点至B 点改为通入二氧化碳气体,至少须标准状况下二氧化碳_____mL。此时发生反应的离子方程式为_____。
(3)B 点含溶质的物质的量是_____mol。C 点(此时沉淀恰好完全溶解)HCl 溶液的体积为_____mL。
【答案】Mg(OH)2 4.28 448 2AlO2-+CO2+3H2O===2Al(OH)3↓+CO32- 0.22 110
【解析】
加入盐酸开始阶段沉淀不溶解,说明反应中氢氧化钠过量,镁离子转化为氢氧化镁沉淀,铝离子转化为偏铝酸钠,氢氧化钠被完全中和后偏铝酸钠和盐酸反应生成氢氧化铝,最后加入的盐酸溶解氢氧化镁和氢氧化铝,结合图象分析解答。
(1)向水中有沉淀物组成的混合溶液中加入盐酸时,0~10mL时没有沉淀生成,说明溶液中NaOH过量,溶液中铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2,即A点沉淀物的化学式为Mg(OH)2;10mL~30mL时盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,该阶段消耗盐酸的物质的量是0.02L×2mol/L=0.04mol,因此生成氢氧化铝是0.04mol,质量是0.04mol×78g/mol=3.12g,则B点纵坐标为3.12+1.16=4.28;
(2)向偏铝酸钠溶液中通入二氧化碳生成氢氧化铝沉淀,方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,0.04mol氢氧化铝消耗0.02mol二氧化碳,标况下的体积是0.02mol×22.4L/mol=0.448L=448mL;
(3)当沉淀质量不再发生变化时溶液中的溶质是NaCl,A点沉淀是氢氧化镁,则n[Mg(OH)2]=1.16g÷58g/mol=0.02mol,根据Mg原子守恒得n(MgCl2)=n[Mg(OH)2]=0.02mol;氢氧化铝的物质的量是0.04mol,根据铝离子守恒可知n(AlCl3)=0.04mol,由Cl-离子守恒得B点含溶质氯化钠的物质的量是0.02mol×2+0.04mol×3+0.03L×2mol/L=0.22mol;根据钠离子守恒可知原混合物中氢氧化钠是0.22mol,C点溶液为MgCl2、AlCl3和NaCl混合液,C点所加盐酸相当于用于中和原混合物中的NaOH,此时所加盐酸物质的量n(HCl)=n(NaOH)=0.22mol,则C点所表示盐酸的体积为0.22mol÷2mol/=0.11L=110mL。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大