题目内容
【题目】室温时,H2S的Ka1=1.0×10-7,Ka2=7.0×10-15。下列说法正确的是
A.0.1 mol·L-1的NaHS溶液中:c(S2-)>c(H2S)
B.反应S2-+H2O![]() HS-+OH-的平衡常数K=1×10-7
HS-+OH-的平衡常数K=1×10-7
C.0.1 mol·L-1的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
D.NaHS与Na2S以任意比混合的溶液中:c(Na+)+c(H+)=c(HS-)+c(S2-)+c(OH-)
【答案】C
【解析】
在H2S溶液中,有![]() =1.0×10-7,
=1.0×10-7,![]() =7.0×10-15,
=7.0×10-15,![]() =10-14。
=10-14。
A.HS-+H2O![]() H2S+OH-,水解平衡常数为:
H2S+OH-,水解平衡常数为:
![]() ,
,![]() >
>![]() ,即HS-的水解程度大于电离程度,故有c(S2-)<c(H2S),A错误;
,即HS-的水解程度大于电离程度,故有c(S2-)<c(H2S),A错误;
B.反应S2-+H2O![]() HS-+OH-的平衡常数:
HS-+OH-的平衡常数:![]() ,B错误;
,B错误;
C.Na2S溶液中,由质子守恒可得:c(OH-)=c(H+)+c(HS-)+2c(H2S),C正确;
D.NaHS与Na2S以任意比混合溶液中,由电荷守恒可得:c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),D错误;
故选C。

【题目】为达到实验目的,下列选用的装置、实验操作均正确的是
实验目的 | 实验步骤和装置 | |
A | 比较H2O2和Fe3+的氧化性 | 将盐酸酸化的双氧水滴入Fe(NO3)2溶液中 |
B | 配制100 mL 1.0 mol·L-1NaOH溶液 | 向100mL容量瓶中加入4.0 g NaOH固体,加水到刻度线 |
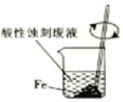
C | 验证牺牲阳极的阴极保护法 |
往铁电极附近滴加铁氰化钾溶液 |
D | 探究温度对反应速率的影响 | 将两片大小相同的淀粉碘化钾试纸分别放置于两支规格相同的试管中,向试纸上滴加2.0 mol·L-1的H2SO4溶液2~3滴,密封试管,分别在室温和40℃水浴中反应,观察并记录变色时间 |
A.AB.BC.CD.D
【题目】高铁酸钾是一种高效多功能的新型非氯绿色消毒剂,主要用于饮水处理。实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
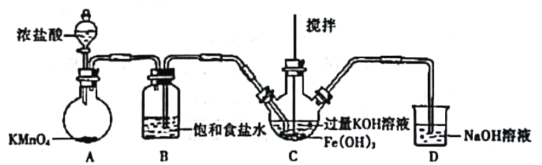
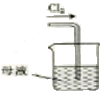
①如图所示,A为氯气发生装置。装置A、B、C、D中存在错误的是______________(填序号)。
②C中得到紫色固体和溶液。C中通入氯气发生反应,生成高铁酸钾(K2FeO4)的化学方程式为_______,此外Cl2还可能与过量的KOH反应。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4,氧化了Cl-而产生Cl2,设计以下方案:
方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i.由方案I中溶液变红可知溶液a中含有__________离子,但该离子的存在不能判断一定是K2FeO4,氧化了Cl2,因为K2FeO4,在酸性溶液中不稳定,请写出K2FeO4在酸性溶液中发生反应的离子方程式___________________________________。
ii.方案Ⅱ可证明K2FeO4,氧化了Cl-.用KOH溶液洗涤的目的是_______________。
②根据K2FeO4的制备实验得出:氧化性Cl2_____FeO42- (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系恰好相反,原因是_______________。
(3)若在制备装置C中加入Fe(OH)3的质量为14.0g,充分反应后经过滤、洗涤、干燥得K2FeO4固体19.3g,则K2FeO4的产率为______________。
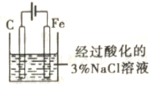
【题目】有关下图所示实验的预测现象不正确的是
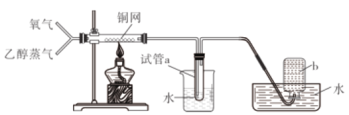
选项 | 操作 | 预测现象 |
A | 通入一段时间的氧气后点燃酒精灯 | 铜网会逐渐变黑 |
B | 通入氧气并加热一段时间后通入乙醇蒸气 | 铜网将逐渐变成红色 |
C | 预先通入氧气排净装置中的空气后再进行实验 | 集气瓶b中不会收集到气体 |
D | 观察试管a中收集到的溶液 | 溶液无色有刺激性气味 |
A.AB.BC.CD.D