题目内容
9.(1)周期表前20号元素中,某两种元素的原子序数相差4,周期数相差1,它们形成化合物的原子数之比为1:1.写出这些化合物的化学式Na2O2、K2S2.(2)已知S2Cl2分子内所有原子的最外层均满足8电子结构,写出它的结构式Cl-S-S-Cl.
(3)碳与它非相邻的短周期元素以极性键形成的化合物中,各原子最外层都达到了8电子稳定结构,写出其中两种化合物的化学式CO2,CCl4.
(4)1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体.等电子体的结构相似、物理性质相近.
①据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是N2、CO和CO2、N2O.
②此后,等电子原理又有所发展.例如,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征.在短周期元素组成的物质中,与NO2-互为等电子体的分子有:SO2、O3.
分析 (1)元素周期表1-20号元素中,某两种元素的原子序数相差3,周期数相差1,可能的组合有H-Be、Na-O、Mg-F、K-S、Ca-Cl、He-B、Ne-Al;
(2)根据S、Cl的最外层电子数以及可以形成的共价键数目判断;
(3)碳与O、Cl形成的二氧化碳和四氯化碳,是以极性键形成的化合物,而且各原子最外层都达到了8电子稳定结构;
(4)①由等电子体的概念结合第二周期的非金属元素B、C、N、O、F入手分析即可;
②要注意的是等电子体的概念有了拓展,NO2价电子数总和为17,与NO2-互为等电子体的三原子分子,其最外层电子数之和应为18,可以从同周期和同族两个方向去考虑元素组成.
解答 解:(1)元素周期表1-20号元素中,某两种元素的原子序数相差3,周期数相差1,可能的组合有H-Be、Na-O、Mg-F、K-S、Ca-Cl、He-B、Ne-Al等,共7种组成,若这样的两种元素形成的化合物中原子数之比为1:1,可能为Na2O2、K2S2,
故答案为:Na2O2、K2S2;
(2)已知S2Cl2分子内所有原子的最外层均满足8电子结构,S最外层6个电子可以形成2个单键,Cl最外层7个电子只能形成一个单键,则它的结构式为:Cl-S-S-Cl;
故答案为:Cl-S-S-Cl;
(3)碳与它非相邻的短周期元素以极性键形成的化合物中,各原子最外层都达到了8电子稳定结构,其中两种化合物的化学式为CO2,CCl4;
故答案为:CO2,CCl4;
(4)①二周期只有八种元素,除了稀有气体元素只有七种,既满足原子数相同又要满足电子数也相同的共价性分子有:N2、CO;CO2、N2O;
故答案为:N2、CO;CO2、N2O;
②NO2-含有三个原子,最外层电子数之和为5+6×2+1=18,由短周期元素的原子组成的三个原子最外层电子数之和为18的微粒有SO2和O3,
故答案为:SO2、O3.
点评 本题考查了周期表中元素位置的关系、8电子结构、等电子体等,侧重于考查学生对基础知识的综合应用能力,题目难度中等,注意把握等电子体的概念.

| A. | 钾的密度比钠的小 | B. | 加热时,钾比钠更易气化 | ||
| C. | 钾与水反应比钠与水反应更剧烈 | D. | 钾原子的电子层比钠原子多一层 |
| A. | 原电池的负极、电解池的阳极均发生氧化反应 | |
| B. | 原电池将化学能转化为电能,电解池将电能转化为化学能 | |
| C. | 电解水制取H2和O2时,为了增强导电性,可加入NaOH、NaCl、H2SO4 | |
| D. | 利用原电池原理可制备化学电源,利用电解池原理可制备化学物质 |
| A. | 用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶 | |
| B. | 煤的主要成分是单质碳、苯、二甲苯等,可通过煤的干馏将它们分离 | |
| C. | 聚氯乙烯塑料可制作保鲜膜、一次性食品袋 | |
| D. | 聚乙烯塑料的老化是由于发生了加成反应 |
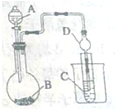 某化学兴趣小组为探究元索性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元索性质的递变规律,设计了如下系列实验. 锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.
锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.