题目内容
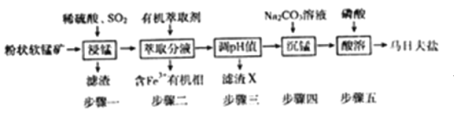
【题目】马日夫盐[Mn(H2PO4)2·2H2O]在国防工业中常用作各种武器的润滑层和防护层。以软锰矿(主要成分为MnO2及少量的FeO、Al2O3和SiO2)为原料制备马日夫盐的主要工艺流程如图:
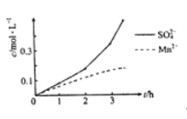
(1)“漫锰”时为了提高浸取率,可采取的措施有_________(任写出一条);在步骤一中,如果SO2气体中混有空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图,产生该现象的原因是_______________;
(2)关于“步骤二”的说法正确的是_________ ;
A.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液
B.溶液中加入萃取剂Y,转移至分液漏斗中。塞上玻璃塞,如图用力振摇

C.经几次振据并放气后,手持分液漏斗静置待液体分层
D.分液时,将分液湿斗上的玻璃塞打开或使塞上的四槽对准漏4口上的小孔,打开旋塞,待油水界面与旋塞上口相切,关闭旋塞后再从上口倒出上层液体
(3)已知几种离子开始沉淀和完全沉淀时的pH如下表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
滤渣X的化学式为_____,步骤三时,pH值应调到的范围是________________;
(4)步骤四时,将Na2CO3溶液逐渐加入锰盐溶液中;若顛倒滴加顺序可能会生成__________已知Ksp(MnCO3)=2.24×10-11,加入饱和Na2CO3溶液使Mn2+恰好沉淀完全后.溶液中c(CO32-)=________;
(5)步骤五产生马日夫盐晶体的化学反应方程式为___________________。
【答案】适当升温、适当增大硫酸浓度、搅拌 Mn2+为SO2(或H2SO3)与O2反应的催化剂 AD Al(OH)3 4.7≤pH<8.3或[4.7,8.3) Mn(OH)2 2.2410-6molL-1 MnCO3+2H3PO4+H2O=Mn(H2PO4)22H2O+CO2↑
【解析】
软锰矿(主要成分为MnO2及少量的FeO、Al2O3和SiO2)加入稀硫酸溶解部分金属氧化物,通入二氧化硫进行步骤一“浸锰”操作,二氧化硫与MnO2发生氧化还原,将二氧化锰转换为Mn2+,步骤一过滤,滤渣是SiO2。步骤二加入有机萃取剂萃取Fe3+,有机相中含有Fe3+经过分液除去,步骤三对无机相进行调节pH值,使Al3+沉淀完全的同时不影响Mn2+,则调节pH范围是大于等于4.7小于8.3,然后进行过滤,滤渣X为Al(OH)3,往滤液中加入Na2CO3溶液进行“沉锰”操作,得到碳酸锰固体,加入磷酸进行酸溶可以得到马日夫盐Mn(H2PO4)2·2H2O。
(1)提高浸取率,一般可以适当增大酸的浓度、适当提高反应温度、搅拌等;步骤一中通入SO2与软锰矿中MnO2发生氧化还原,将MnO2转换为Mn2+,将SO2转化为SO42-,随着二氧化硫通入量增加,Mn2+和SO42-同等程度增大。若SO2气体中混有空气,空气中的氧气可以作氧化剂,代替MnO2,根据浓度时间变化图,开始一段时间化学反应速率较慢,Mn2+和SO42-浓度同等程度略有增大,说明氧气几乎没反应,在2h后SO42-浓度明显增大,此时Mn2+保持平缓,说明在此过程发生SO2和空气中氧气的氧化还原反应,且Mn2+作催化剂;
(2)利用物质在两种互不相溶的溶剂中溶解度的不同,式物质从一种溶剂内转移到另外一种溶剂中。物质在两种溶剂中有着不同的溶解度,称为分配定律。需要经过反复多次萃取,才可以提高萃取率和产品产率,故A项实验时分多次萃取并合并萃取液说法是正确的;萃取分液的操作如下:1.检查分液漏斗是否漏水;2.在分液漏斗中先装入溶液再加入萃取剂Y;3.振荡摇匀:塞上玻璃塞,右手拇指压住瓶塞,左手按住分液漏斗的活塞,保证不漏液,做倒转振荡,让两种液体充分混合,过程中压强增大,通过活塞放气。故B说法错误;4.将分液漏斗放置在铁架台上静置分层,C项说法错误;5.分液:将分液湿斗上的玻璃塞打开或使塞上的四槽对准漏4口上的小孔,打开旋塞,待油水界面与旋塞上口相切,关闭旋塞后再从上口倒出上层液体,分液完成,故D项说法正确;故选AD。
(3)通过分析可知,滤渣X为Al(OH)3;由离子开始沉淀和沉淀完全的pH表格可得,使Al3+沉淀完全,pH应大于等于4.7,但同时不影响Mn2+,不能使Mn2+沉淀,pH应小于8.3,故在步骤三pH应调到的范围是4.7≤pH<8.3或[4.7,8.3);
(4)步骤四时,若将Mn2+溶液滴加到Na2CO3溶液中,Na2CO3溶液显碱性,使得Mn2+沉淀生成Mn(OH)2;加入饱和Na2CO3溶液使Mn2+恰好沉淀完全生成MnCO3,溶液中存在碳酸锰的沉淀溶解平衡Ksp(MnCO3)=c(Mn2+)·c(CO32-),Mn2+恰好沉淀完全指的是c(Mn2+)=1.0×10-5,故溶液中c(CO32-)=![]() ;
;
(5)步骤五得到的MnCO3用磷酸进行酸溶,通过主要主要产物的分析,该反应没有化合价变化,不属于氧化还原,碳酸锰中的碳酸根在酸性环境下转化为二氧化碳,故产生马日夫盐晶体的化学反应方程式为:MnCO3+2H3PO4+H2O=Mn(H2PO4)22H2O+CO2↑。

 天天练口算系列答案
天天练口算系列答案