题目内容
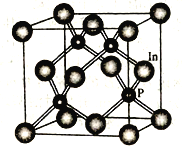
【题目】已知铅(Pb)与硅同主族且Pb比Si多3个电子层。
(1)难溶物PbSO4溶于CH3COONH4溶液可制得(CH3COO)2Pb[(CH3COO)2Pb易溶于水],发生的反应为PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4,说明(CH3COO)2Pb是______(填“强”或“弱”)电解质。
(2)将PbO2加入硝酸酸化的Mn(NO3)2溶液中搅拌后溶液显紫红色;则每反应1 mol Mn(NO3)2转移____________mol电子。
(3)在汽车尾气系统中装置催化转化器,可有效降低尾气中的CO、NO、NO2和碳氢化合物等污染性气体。在催化转换器的前半部,CO和NO在催化剂的作用下发生反应,生成两种无污染的气体,该反应的化学方程式为:___________________________________。
(4)①在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,溶液变蓝色,且反应后溶液呈碱性,发生反应的离子方程式是______________。
②在上述碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠溶液,发现蓝色逐渐消失,写出发生反应的离子方程式是______________。
(5)处理含Cr2O72-的废水可先用(NH4)2Fe(SO4)2将Cr2O72-转化为Cr3+,再用氨水将Cr3+转变为难溶的Cr(OH)3,在该过程中氧化剂为______________,其中氨水转化Cr3+为Cr(OH)3的离子方程式为____________________________________________;该方案处理后的废水中因含有大量________元素,直接排放会导致水体富营养化。
【答案】弱 5 2CO + 2NO![]() 2CO2 + N2 ClO-+2I-+H2O=I2+Cl-+2OH- SO32-+I2+2OH-=SO42-+2I-+H2O Cr2O72- Cr3+ + 3NH3·H2O=Cr(OH)3↓ + 3NH4+ 氮(或N)
2CO2 + N2 ClO-+2I-+H2O=I2+Cl-+2OH- SO32-+I2+2OH-=SO42-+2I-+H2O Cr2O72- Cr3+ + 3NH3·H2O=Cr(OH)3↓ + 3NH4+ 氮(或N)
【解析】
(1)根据发生复分解反应的条件,醋酸铅为弱电解质;
(2)PbO2加入硝酸酸化Mn(NO3)2溶液中搅拌后溶液显紫红色,说明Mn2+被氧化成MnO4-,1molMn(NO3)2被氧化,转移电子物质的量为1mol×(7-2)=5mol;
(3)CO和NO反应生成无污染的气体即产生CO2和N2,化学反应方程式为2CO+2NO![]() 2CO2+N2;
2CO2+N2;
(4)①溶液变蓝,说明有I2生成,利用ClO-的强氧化性,把I-氧化成I2,本身被还原为Cl-,反应后溶液显碱性,说明有OH-生成,即发生离子方程式为ClO-+2I-+H2O=I2+Cl-+2OH-;
②Na2SO3具有还原性,I2具有强氧化性,该溶液显碱性,即离子方程式为SO32-+I2+2OH-=SO42-+2I-+H2O;
(5)Cr2O72-中Cr的化合价由+6价→+3价,化合价降低,Cr2O72-为氧化剂,(NH4)2Fe(SO4)2中Fe显+2价,Fe的化合价升高,即Fe2+为还原剂,NH3·H2O为弱碱,Cr3+与NH3·H2O反应的离子方程式为Cr3++3NH3·H2O=Cr(OH)3↓+3NH4+;该方案处理后的废水中含有大量的N元素,是植物生长必需的元素,直接排放会导致水体富营养化。

【题目】化合物A、B是中学常见的物质,其阴阳离子可从表中选择.
阳离子 | K+、Na+、NH4+、Fe2+、Ba2+、Cu2+ |
阴离子 | OH﹣、I﹣、NO3﹣、AlO2﹣、HCO3﹣、HSO4﹣ |
(1)若A的水溶液为无色,B的水溶液呈碱性,A、B的水溶液混合后,只产生不溶于稀硝酸的白色沉淀及能使湿润的红色石蕊试纸变蓝的气体,则:
①A中的化学键类型为_________(填“离子键”、“共价键”).
②A、B溶液混合后加热呈中性,该反应的离子方程__________________________ .
(2)若A的水溶液为浅绿色,B的焰色反应呈黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合后无明显变化.则:
①A的化学式为__________________________ .
②经分析上述过程中溶液变黄的原因可能有两种(请用文字叙述)
Ⅰ._______________________.Ⅱ._________________________.
③请用一简易方法证明上述溶液变黄的原因_________________________.
④利用上述过程中溶液变黄原理,将其设计成原电池,若电子由a流向b,则b极的电极反应式为_.
【题目】马日夫盐[Mn(H2PO4)2·2H2O]在国防工业中常用作各种武器的润滑层和防护层。以软锰矿(主要成分为MnO2及少量的FeO、Al2O3和SiO2)为原料制备马日夫盐的主要工艺流程如图:
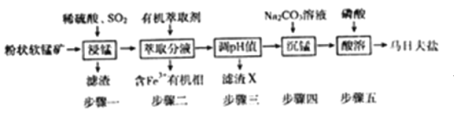
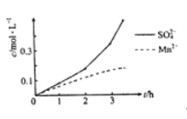
(1)“漫锰”时为了提高浸取率,可采取的措施有_________(任写出一条);在步骤一中,如果SO2气体中混有空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图,产生该现象的原因是_______________;
(2)关于“步骤二”的说法正确的是_________ ;
A.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液
B.溶液中加入萃取剂Y,转移至分液漏斗中。塞上玻璃塞,如图用力振摇

C.经几次振据并放气后,手持分液漏斗静置待液体分层
D.分液时,将分液湿斗上的玻璃塞打开或使塞上的四槽对准漏4口上的小孔,打开旋塞,待油水界面与旋塞上口相切,关闭旋塞后再从上口倒出上层液体
(3)已知几种离子开始沉淀和完全沉淀时的pH如下表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
滤渣X的化学式为_____,步骤三时,pH值应调到的范围是________________;
(4)步骤四时,将Na2CO3溶液逐渐加入锰盐溶液中;若顛倒滴加顺序可能会生成__________已知Ksp(MnCO3)=2.24×10-11,加入饱和Na2CO3溶液使Mn2+恰好沉淀完全后.溶液中c(CO32-)=________;
(5)步骤五产生马日夫盐晶体的化学反应方程式为___________________。