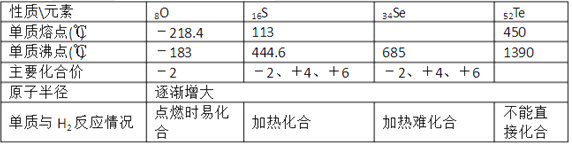
题目内容
【题目】2020年3月11日注射用西维来司他钠获得国家药监局批准上市,用于治疗新冠病毒等造成的急性肺损伤,化合物F是合成该药物的中间体,其合成路线如下:
(1)E中官能团的名称是______;
(2)写出C的结构简式_______________;
(3)写出符合下列条件的B的一种同分异构体___________________;
①能发生水解反应且能发生银镜反应
②遇FeCl3溶液显蓝紫色
(4)反应A→B所需试剂及条件_________________;
(5)反应B→C的反应类型___________________;
(6)写出D→E的化学反应方程式_______________________;
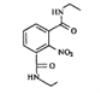
(7)参考本题信息,写出由间二甲苯与NH2CH2CH制备下图有机物的合成线路_________(无机试剂任选) 。
![]()
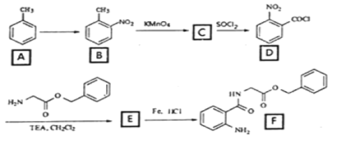
【答案】肽键、酯基、硝基 
 (两个官能团在对位或间位也可以) 浓硫酸、浓硝酸、加热(浓H2SO4、浓HNO3、△) 氧化反应
(两个官能团在对位或间位也可以) 浓硫酸、浓硝酸、加热(浓H2SO4、浓HNO3、△) 氧化反应 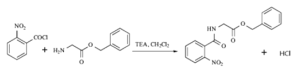

【解析】
甲苯经过硝化反应生成邻硝基甲苯,邻硝基甲苯被酸性高酸酸钾氧化生成C,C是邻硝基苯甲酸 ,C与SOCl2发生取代反应,生成D邻硝基苯甲酰氯
,C与SOCl2发生取代反应,生成D邻硝基苯甲酰氯 ,由E在Fe/HCl作用下生成F,发生硝基还原,则E的结构为
,由E在Fe/HCl作用下生成F,发生硝基还原,则E的结构为 。
。
(1)由分析可知,E 中官能团的名称是肽键、酯基、硝基;
中官能团的名称是肽键、酯基、硝基;
(2)由分析可知,C的结构简式 ;
;
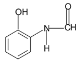
(3)符合B的一种同分异构体:①能发生水解反应且能发生银镜反应,分子内存在HCONH-,②遇FeCl3溶液显蓝紫色,分子内含有-OH,故符合题意的B的同分异构体 (两个官能团在对位或间位也可以);
(两个官能团在对位或间位也可以);
(4)由分析可知,A→B发生硝化反应,故所需试剂及条件浓硫酸、浓硝酸、加热(浓H2SO4、浓HNO3、△);
(5)反应B→C经酸性高锰酸钾氧化,-CH3转化为-COOH,故反应B→C的反应类型为氧化反应;
(6)由分析可知E的结构简式 ,D→E发生取代,分子间脱去一分子HCl,故化学反应方程式
,D→E发生取代,分子间脱去一分子HCl,故化学反应方程式 ;
;
(7)由原料和产物对比分析,间二甲苯需要先引入硝基,后经过氧化转化为-COOH,与SOCl2发生取代反应得到酰氯,然后可以与氨基发生脱HCl生成肽键,故制备流程是: 。
。

【题目】马日夫盐[Mn(H2PO4)2·2H2O]在国防工业中常用作各种武器的润滑层和防护层。以软锰矿(主要成分为MnO2及少量的FeO、Al2O3和SiO2)为原料制备马日夫盐的主要工艺流程如图:

(1)“漫锰”时为了提高浸取率,可采取的措施有_________(任写出一条);在步骤一中,如果SO2气体中混有空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图,产生该现象的原因是_______________;

(2)关于“步骤二”的说法正确的是_________ ;
A.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液
B.溶液中加入萃取剂Y,转移至分液漏斗中。塞上玻璃塞,如图用力振摇

C.经几次振据并放气后,手持分液漏斗静置待液体分层
D.分液时,将分液湿斗上的玻璃塞打开或使塞上的四槽对准漏4口上的小孔,打开旋塞,待油水界面与旋塞上口相切,关闭旋塞后再从上口倒出上层液体
(3)已知几种离子开始沉淀和完全沉淀时的pH如下表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
滤渣X的化学式为_____,步骤三时,pH值应调到的范围是________________;
(4)步骤四时,将Na2CO3溶液逐渐加入锰盐溶液中;若顛倒滴加顺序可能会生成__________已知Ksp(MnCO3)=2.24×10-11,加入饱和Na2CO3溶液使Mn2+恰好沉淀完全后.溶液中c(CO32-)=________;
(5)步骤五产生马日夫盐晶体的化学反应方程式为___________________。