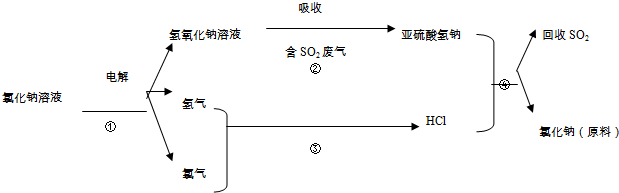
题目内容
19.乙二酸( HOOC-COOH)俗称草酸,易溶于水,电离常数K1=5.4×10-2,K2=5.4×10-5,其盐草酸钙和草酸氢钙均为白色不溶物.无色晶体H2C2O4•2H2O称为草酸晶体,其熔点为101.5℃.草酸晶体失去结晶水得无水草酸,它在157℃升华.根据上述信息,回答下列问题.
(1)向盛有2mL饱和NaHCO3溶液的试管里加入少量乙二酸浓溶液,观察到有大量气泡产生,写出该反应的离子方程式:2HCO3-+H2C2O4=2H2O+2CO2↑+C2O42-.(碳酸:K1=4.4×10-7)
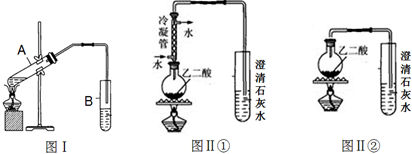
(2)向试管A中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙二酸溶液,按下图Ⅰ组装好装置,加热3-5min.在装有饱和Na2CO3溶液的试管B中有油状且带有香味的液体产生.B中导管口在液面上而不伸入液面下的原因是防止倒吸.写出乙二酸与少量乙醇反应的化学反应方程式
 .
.
(3)已知草酸分解的化学方程式为:H2C2O2$\stackrel{187℃}{→}$H2O+CO2↑+CO↑
利用图Ⅱ①和图Ⅱ②加热草酸晶体(夹持仪器忽略),以验证草酸受热是否分解.连续加热一段时间后的现象是:
图Ⅱ①:试管里澄清石灰水先变浑浊,后又变澄清;
图Ⅱ②:试管里澄清石灰水只变浑浊.
能验证草酸受热分解的装置是①(填图Ⅱ中的编号“①”或“②”).
(4)图Ⅱ①中冷凝管的作用是:冷凝回流草酸蒸气,防止生成草酸盐沉淀对CO2的检出造成干扰.
分析 (1)由电离常数可知,HC2O4-酸性大于碳酸,应生成C2O42-、二氧化碳、水;
(2)乙二酸与少量乙醇反应生成乙二酸乙酯,注意防止倒吸;
(3)如乙二酸分解,则生成二氧化碳气体,可使澄清石灰水变浑浊,但要排出乙二酸钙的影响;
(4)为防止乙二酸的影响,用冷凝管进行分离.
解答 解:(1)由电离常数可知,HC2O4-酸性大于碳酸,应生成C2O42-、二氧化碳、水,反应的离子方程式为2HCO3-+H2C2O4=2H2O+2CO2↑+C2O42-,
故答案为:2HCO3-+H2C2O4=2H2O+2CO2↑+C2O42-;
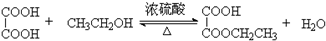
(2)乙二酸与少量乙醇反应生成乙二酸乙酯,方程式为 ,因生成物含有乙醇,易溶于水,为防止倒吸,则导管口在液面上而不伸入液面下,
,因生成物含有乙醇,易溶于水,为防止倒吸,则导管口在液面上而不伸入液面下,
故答案为:防止倒吸; ;
;
(3)①试管里澄清石灰水先变浑浊,后又变澄清,说明生成二氧化碳,二氧化碳先与氢氧化钙反应生成碳酸钙,碳酸钙与二氧化碳反应生成碳酸氢钙,
故答案为:①;
(4)乙二酸沸点较高,加热时,为防止乙二酸与氢氧化钙反应生成草酸钙对实验现象、结论有影响,则应用冷凝管进行蒸馏分离,
故答案为:冷凝回流草酸蒸气,防止生成草酸盐沉淀对CO2的检出造成干扰.
点评 本题考查性质实验的探究,侧重于学生的分析、实验能力的考查,注意把握实验的原理、目的和操作方法,题目难度中等.

练习册系列答案
相关题目
19.现有一定量的Cu和CuO混合物,向其中加入0.6L 2.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况).向所得溶液中加入一定体积1.0mol/L NaOH溶液,恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧后得32.0g固体.(忽略溶液的体积变化).
下列说法正确的是( )
下列说法正确的是( )
| A. | 该混合物中铜的质量为19.2 g | |
| B. | 与该混合物反应消耗的HNO3的量为1.2 mol | |
| C. | 加入NaOH溶液的体积是800 mL | |
| D. | Cu2+沉淀完全后,溶液中c(NO3-)为0.7 mol/L |
20.一定条件下,在容积为1L密闭容器发生可逆反应:A(g)+2B(g)?2C(g),实验测得当生成2mol C时,放出了QkJ的热量.若条件不变起始向容器中充入1mol C,则反应达平衡时的热效应为( )
| A. | 放出0.5QkJ的热量 | B. | 吸收0.5QkJ的热量 | ||
| C. | 放出的热量小于0.5QkJ | D. | 吸收的热量小于0.5QkJ |
7.下列实验过程中,溶液的pH减小的是( )
| A. | 以碳棒为两极电解氢氧化钠溶液 | B. | 向稀盐酸中滴加NaOH溶液 | ||
| C. | 以碳棒为两极电解饱和氯化钠溶液 | D. | 向氢氧化钠溶液中加水 |
14.分别燃烧等物质的量的下列各组物质,其中消耗氧气的量相等的是( )
①C2H2与C2H4O ②C4H8与C6H12O6 ③C7H8与C6H12 ④HCOOCH3与CH3COOH.
①C2H2与C2H4O ②C4H8与C6H12O6 ③C7H8与C6H12 ④HCOOCH3与CH3COOH.
| A. | ①③④ | B. | ①②③④ | C. | ①④ | D. | ①②④ |
4.某同学做元素周期律性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表(记录现象时随手记在纸片上,不对应,需整理):
请帮助该同学整理并完成实验报告.
(1)实验目的:验证Na、Mg、Al、S、Cl元素从左到右金属性依次减弱、非金属性依次增强的规律.
(2)实验用品:试管、酒精灯、砂纸、镊子、小刀、胶头滴管.
(3)实验内容:
(4)实验结论:同周期元素随原子序数增大,元素金属性逐渐减弱,非金属性逐渐增强.
(5)请用物质结构理论简单说明具有上述结论的原因同周期元素,随原子序数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强.
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动随之消失,溶液变成红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 | B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 | C.反应不十分剧烈,产生气体可以在空气中燃烧 |
| ④镁带与2mol•L-1的盐酸反应 | D.剧烈反应,产生的气体可以在空气中燃烧 |
| ⑤铝条与2mol•L-1的盐酸反应 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向氯化铝溶液中滴加氢氧化钠 | F.生成淡黄色沉淀 |
(1)实验目的:验证Na、Mg、Al、S、Cl元素从左到右金属性依次减弱、非金属性依次增强的规律.
(2)实验用品:试管、酒精灯、砂纸、镊子、小刀、胶头滴管.
(3)实验内容:
| 实验方案 (填序号) | 实验现象 (填序号) | 有关化学方程式 |
(5)请用物质结构理论简单说明具有上述结论的原因同周期元素,随原子序数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强.
8.烧杯中盛有100mL 0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图.下列说法正确的是( )


| A. | 曲线a表示Ba2+的物质的量的变化 | |
| B. | 曲线c表示OH-的物质的量的变化 | |
| C. | 加入Ba(OH)2溶液50mL时反应的离子方程式为:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 加入Ba(OH)2溶液大于50mL后,反应的离子方程式为:OH-+H+═H2O |
9.下列叙述错误的是( )
| A. | 用灼烧的方法可以鉴别羊毛和棉花 | |
| B. | 用饱和碳酸钠溶液除去乙酸乙酯中的乙酸 | |
| C. | 用酒精清洗沾到皮肤上的苯酚 | |
| D. | 用酸性高猛酸钾溶液鉴别甲苯和苯乙烯 |