题目内容
11.海水占地球总储水量的97.2%.若把海水淡化和化工生产结合起来(1)海水中含有大量的氯化钠.氯化钠中的金属元素位于元素周期表第IA族.
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法.蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是物理变化(填物理变化、化学变化)
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
食盐+H2O→NaOH+H2+Cl2(未配平).该反应中食盐的化学式是NaCl.利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐585t.
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:
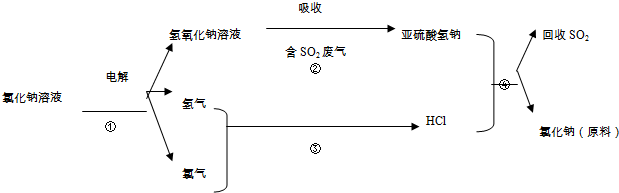
写出②④的化学反应方程式:NaOH+SO3═NaHSO3;NaHSO3+HCl═NaCl+H2O+SO2↑
(5)上述亚硫酸氢钠与甲醛经过一定反应,可以合成俗称“吊白块”(雕白粉)的物质.因吊白块对人体有害,不能用于食品漂白.其结构简式为:HOCH2SO3Na,根据其结构特点,吊白块能发生的反应有:CD
A.皂化反应 B.聚合反应 C.与金属钠反应 D.氧化反应.
分析 (1)主族元素最高化合价与其族序数相等;
(2)有新物质生成的变化是化学变化,没有新物质生成的变化是物理变化;
(3)根据元素守恒知,食盐中含有Na、Cl元素,根据原子守恒知,其化学式为NaCl;
根据氯原子守恒计算需要氯化钠质量;
(4)二氧化硫是酸性氧化物,能和少量强碱反应生成亚硫酸氢盐和水;亚硫酸氢钠和稀盐酸发生复分解反应生成氯化钠和二氧化硫、水;
(5)吊白块中含有醇羟基、亚硫酸根离子,具有醇和亚硫酸盐性质.
解答 解:(1)主族元素最高化合价与其族序数相等,NaCl中Na元素最高化合价是+1价,所以Na位于第IA族,故答案为:ⅠA;
(2)有新物质生成的变化是化学变化,没有新物质生成的变化是物理变化,根据题干知,蒸馏只是物质状态发生变化,没有新物质生成,所以属于物理变化,故答案为:物理变化;
(3)根据元素守恒知,食盐中含有Na、Cl元素,根据原子守恒知,其化学式为NaCl;
根据氯原子守恒得关系式NaCl----HCl,
设需要氯化钠的质量为x,
NaCl----HCl
58.5 36.5
x 1000t×36.5%
58.5:36.5=x:(1000t×36.5%)
x=$\frac{1000t×36.5%×58.5}{36.5}$=585t,
故答案为:NaCl;585;
(4)二氧化硫是酸性氧化物,能和少量强碱反应生成亚硫酸氢盐和水,反应方程式为NaOH+SO3═NaHSO3;亚硫酸氢钠和稀盐酸发生复分解反应生成氯化钠和二氧化硫、水,反应方程式为NaHSO3+HCl═NaCl+H2O+SO2↑,
故答案为:NaOH+SO3═NaHSO3;NaHSO3+HCl═NaCl+H2O+SO2↑;
(5)吊白块中含有醇羟基、亚硫酸根离子,具有醇和亚硫酸盐性质,能和钠反应生成氢气,能被强氧化剂氧化而发生氧化反应,不含酯基和碳碳不饱和键,所以不能发生皂化反应、聚合反应,故选C、D.
点评 本题考查海水资源综合利用,涉及化学方程式的书写、物质性质判断、物理变化判断等知识点,侧重考查基础知识,熟悉常见元素化合物知识即可解答,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. |  | B. | H+[O]2-H+ | C. | Na+[Cl]- | D. | Mg2+[F]$_2^-$ |
| A. | 苯(苯酚) 加浓溴水,振荡,分液 | |
| B. | 福尔马林(甲酸) 加纯碱溶液,分液 | |
| C. | 乙醇(乙酸) 加NaOH溶液,过滤 | |
| D. | 乙酸乙酯(乙酸) 加饱和Na2CO3溶液,分液 |

| A. | 在0~a范围内,只发生中和反应 | |
| B. | ab段发生反应的离子方程式为CO32-+2H+═H2O+CO2 | |
| C. | 原混合溶液中NaOH和Na2CO3的物质的量浓度之比为2:1 | |
| D. | c点对应的溶液中还能大量存在Fe2+、NO3-离子 |
| A. |  实验室制取NH3 | B. |  溶液颜色褪去 | C. |  看到光亮的通路 | D. |  石油蒸馏 |
| A. | 燃烧汽油产生的汽车尾气中所含的大气污染物主要是CO,NO、SO2、CO2等 | |
| B. | 乙醇、次氯酸钠溶液均可以将病毒氧化而消毒 | |
| C. | 用纯碱溶液清洗餐具上的油污时,加热可以提高去污能力 | |
| D. | 火力发电是将化学能直接转化为电能 |
 .
.
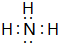 ,空间结构为三角锥形.
,空间结构为三角锥形.