题目内容
16.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1 molNa2O2中含有的离子总数为4 NA | |
| B. | 0.1 mol羟基(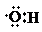 )中含有的电子数为0.7 NA )中含有的电子数为0.7 NA | |
| C. | 室温下,1 L pH=13的NaOH溶液中,水电离出的OH-的数目为0.1 NA | |
| D. | 在5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O中,生成28 g N2时转移的电子数目为3.75 NA |
分析 A、Na2O2由钠离子和过氧根离子构成;
B、羟基不显电性;
C、在氢氧化钠溶液中,水的电离被抑制;
D、此反应中,每生成4mol氮气,转移15mol电子.
解答 解:A、Na2O2由2个钠离子和1个过氧根离子构成,故1molNa2O2中含3mol离子,故A错误;
B、羟基不显电性,故1mol羟基含9mol电子,故0.1mol羟基含0.9mol电子,故B错误;
C、在氢氧化钠溶液中,水的电离被抑制,溶液中的氢氧根几乎全部是由氢氧化钠电离出的,而氢离子全部来自于水的电离,故溶液中水电离出的OH-的数目N=nNA=10-13mol/L×1L×NA=10-13NA,故C错误;
D、此反应中,每生产4mol氮气,转移15mol电子,故生成28 g N2即1mol氮气转移的电子数目为3.75 NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
6.区分胶体和溶液的实验方法可行的是( )
| A. | 观察颜色 | B. | 一束光照射 | C. | 静置沉降 | D. | 过滤 |
7.二苯并呋哺结构简式为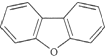 ,其一氯代物有( )
,其一氯代物有( )
 ,其一氯代物有( )
,其一氯代物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
4.下表是元素周期表的一部分,元素Z为短周期元素,R的一种核素在考古时常用于鉴定一些文物的年代.下列叙述中正确的是( )
| R | X | |||
| W | Y | Z |
| A. | W的氧化物属于酸性氧化物,与一切酸都不能发生反应 | |
| B. | Z的单质可用于杀灭田鼠 | |
| C. | Y、Z的最高价氧化物对应的水化物的酸性:Y>Z | |
| D. | X、Y的氢化物的沸点:Y>X |
8. 近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
I.CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△H1=+218.4kJ•mol-l
Ⅱ.CaO(s)+3CO(g)+SO2(g?CaS(s)+3CO2(g)△H2=-394.0kJ•mol-l
(1)若用K1、K2分别表示反应I、II的化学平衡常数,则反应$\frac{1}{2}$CaSO4(s)+2CO(g)?$\frac{1}{2}$CaS(s)+2CO2(g)的平衡常数K=$({K}_{1}•{K}_{2})^{\frac{1}{2}}$(用含K1、K2的式子表示)
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:
前20s 内v(SO2)=0.09mo1•L-l•s-l,平衡时CO的转化率为70%.
(3)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量,对反应II
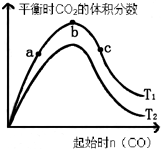
CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是c.
②图象中T2高于T1(填“高于”、“低于”、“等于”或“无法确定”)判断的理由是反应是放热反应,升高温度,平衡逆向进行,二氧化碳含量减小,所以T2>T1.
 近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:I.CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△H1=+218.4kJ•mol-l
Ⅱ.CaO(s)+3CO(g)+SO2(g?CaS(s)+3CO2(g)△H2=-394.0kJ•mol-l
(1)若用K1、K2分别表示反应I、II的化学平衡常数,则反应$\frac{1}{2}$CaSO4(s)+2CO(g)?$\frac{1}{2}$CaS(s)+2CO2(g)的平衡常数K=$({K}_{1}•{K}_{2})^{\frac{1}{2}}$(用含K1、K2的式子表示)
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:
| t/s | 0 | 10 | 20 | 30 | 50 |
| c(CO)mol/L | 3 | 1.8 | 1.2 | 0.9 | 0.9 |
(3)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量,对反应II
CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是c.
②图象中T2高于T1(填“高于”、“低于”、“等于”或“无法确定”)判断的理由是反应是放热反应,升高温度,平衡逆向进行,二氧化碳含量减小,所以T2>T1.


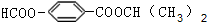 .
.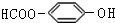 . (写结构简式)
. (写结构简式)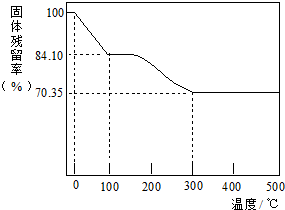
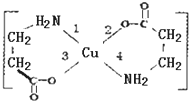 II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:
II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图: 已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题:
已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题: