题目内容
1.某天然碱的化学组成为aNa2CO3•bNaHCO3•cH2O(a、b、c为正整数),为确定该天然碱的组成,进行如下实验.准确称m g样品在空气中加热,样品的固体残留率.固体残留率=$\frac{固态样品的剩余质量}{固体样品的起始质量}$×100%它随温度的变化如图所示,样品在100℃时已完全失去结晶水,300℃时NaHCO3已分解完全,Na2CO3的分解温度为1800℃).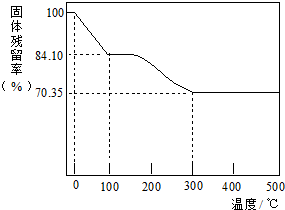
(1)加热过程中,保持100℃足够长时间,而不持续升温的原因是确保晶体中的结晶水失去完全,同时防止稍稍升温引起NaHCO3分解.
(2)根据以上实验数据计算该天然碱中a:b:c=1:1:2(写出计算过程).
(3)另取0.1130g样品配成溶液,逐滴加入5.00mL的HCl溶液,生成CO2 5.60mL(标准状况),则c(HCl)=0.1500mol•L-1.
分析 (1)碳酸氢钠受热易分解,保持100℃,使结晶水失去,而不引起NaHCO3分解;
(2)假设固体为100g,根据固体残留率求出水的质量、碳酸氢钠的质量和碳酸钠的质量,再分别求出物质的量,根据物质的量之比计算a、b、c;
(3)根据aNa2CO3•bNaHCO3•cH2O与HCl反应中物质的量的关系计算.
解答 解:(1)已知在100℃时,晶体失去结晶水,而不引起NaHCO3分解,所以加热过程中,保持100℃足够长时间,确保晶体中的结晶水失去完全,同时防止稍稍升温引起NaHCO3分解;
故答案为:确保晶体中的结晶水失去完全,同时防止稍稍升温引起NaHCO3分解;
(2)假设固体为100g,则水的物质的量为$\frac{100-84.10}{18}$mol,
100℃---300℃固体减少的质量为碳酸氢钠分解生成的二氧化碳和水的质量,2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2+H2O,则NaHCO3的物质的量为($\frac{84.10-70.35}{62}$×2)mol,
最后剩余的固体为原来的碳酸钠和碳酸氢钠分解生成的碳酸钠,则原来是碳酸钠的物质的量为($\frac{70.35}{106}$-$\frac{84.10-70.35}{62}$)mol,
则a:b:c=($\frac{70.35}{106}$-$\frac{84.10-70.35}{62}$):($\frac{84.10-70.35}{62}$×2):$\frac{100-84.10}{18}$=1:1:2;
故答案为:1:1:2;
(3)由以上分析可知,该物质的化学式为Na2CO3•NaHCO3•2H2O,则其物质的量为$\frac{0.113g}{226g/mol}$=0.0005mol,n(CO2)=$\frac{0.0056L}{22.4L/mol}$=0.00025mol,
Na2CO3 +HCl=NaHCO3 +NaCl
0.0005mol 0.0005mol
NaHCO3 +HCl=NaCl+CO2↑+H2O
0.00025mol 0.00025mol
则c(HCl)=$\frac{n}{V}$=$\frac{0.0005mol+0.00025mol}{0.005L}$=0.1500 mol/L,
故答案为:0.1500.
点评 本题考查了碳酸钠和碳酸氢钠、有关化学方程式的计算,题目难度中等,侧重于考查学生的分析能力和计算能力,注意根据图象分析固体的成分.

| A. | H2SO4溶液 | B. | HCl溶液 | C. | NaOH溶液 | D. | NaNO3溶液 |
| A. | 25℃时,O.1 mol•L-1HF溶液pH=l,Ksp(CaF2)随温度和浓度的变化而变化 | |
| B. | 向1L0.2 mol•L-1HF溶液中加入1L O.2 mol•L-1CaCl2溶液,没有沉淀产生 | |
| C. | AgCl不溶于水,不能转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11mol•L-1 |

| A. | 原混合物中n[Ba(OH)2]:n[NaOH]=1:2 | |
| B. | p点横坐标为120 | |
| C. | p点中溶质为Ba(HCO3)2 | |
| D. | ab段反应可分两段,离子方程式依次为:CO2+2OH-=H2O+CO32- CO2+H2O+CO32-=2HCO3- |
| A. | 1 molNa2O2中含有的离子总数为4 NA | |
| B. | 0.1 mol羟基(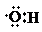 )中含有的电子数为0.7 NA )中含有的电子数为0.7 NA | |
| C. | 室温下,1 L pH=13的NaOH溶液中,水电离出的OH-的数目为0.1 NA | |
| D. | 在5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O中,生成28 g N2时转移的电子数目为3.75 NA |
| 微粒 | A | B | C | D |
| 原子核数 | 双核 | 多核 | 多核 | 多核 |
| 所带单位电荷 | -1 | 0 | +1 | 0 |
(1)1个B分子中含有3个σ键;
(2)室温下,等物质的量的B与盐酸反应,写出反应后溶液中溶质的分子式:NH4Cl,该溶质微粒中存在ABD.
A.离子键 B.极性键 C.非极性键 D.配位键
(3)B极易溶于D中的原因是分子间氢键;由于相同的原因,物质E也极易溶于D中,且E分子也含有10个电子.
 氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).
氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).【查阅资料】
①Cu2+可作为双氧水氧化法破氛处理过程中的催化剂;
②Cu2十在偏碱性条件下对双氧水分解影响较弱,可以忽略不计;
③[Fe(CN)6]3-较CN一难被双氧水氧化,pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
[实脸设计]
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验.
(l)请完成以下实验设计表(表中不要留空格).
| 实验序号 | 实验目的 | 初始pH | 废水样品体积mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考废水的初始pH对 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氯反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 10 |
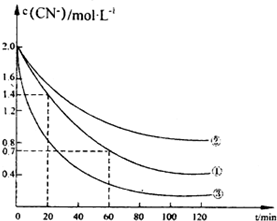
实验测得含氰废水中的总氰浓度(以CN一表示)随时间变化关系如图所示.
(2》实验①中2060min时间段反应速率v(CN-)=0.0175mol•L-1.min-1
【解释和给论]
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化(填一点即可).在偏碱性条件下,含氰废水中的CN一最终被双氧水氧化为HC03,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实脸并验证上述结论,完成下表中内容.
(己知:废水中的CN一浓度可用离子色谱仪测定)
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |