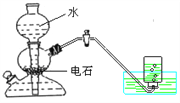
��Ŀ����
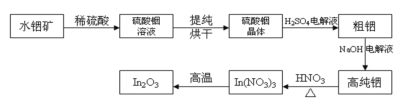
����Ŀ��In�ǵ�5����IIIA��Ԫ�أ�In2O3��һ�����ĵ�����ϣ��������ڴ�������Һ����ʾ���ȸ߿Ƽ���������ˮ������Ҫ�ɷ�In(OH)3���Ʊ�In2O3�Ĺ����������£�
��1��д��ˮ�����������ܵ����ӷ���ʽ��_____________________________
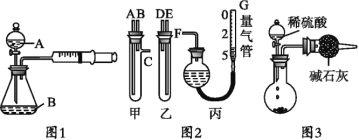
��2������������Һ���Ʊ������������ʵ�鲽�裺__________��_________�����ˡ�ϴ�Ӻ��
��3���ᴿ�����ķ�����ͭ�ľ���ԭ�����ƣ������Ϊ___________��������������������������д�������ĵ缫��Ӧʽ_________________________��
��4��������л�ѧ����ʽ��__________
![]() In(NO3)3
In(NO3)3![]()
![]() In2O3
In2O3![]()
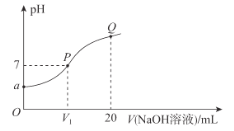
��5����֪t��ʱ����ӦIn2O3��CO![]() 2InO��CO2��ƽ�ⳣ��K=0.25��
2InO��CO2��ƽ�ⳣ��K=0.25��
i��t��ʱ����Ӧ�ﵽƽ��ʱ��n(CO):n(CO2)=___________��
ii����1L���ܱ������м���0.02mol��In2O3��s������ͨ��x mol��CO��t��ʱ��Ӧ�ﵽƽ�⡣��ʱIn2O3��ת����Ϊ50%����x=_________��
��6���ߴ�����Ũ���ᷴӦ�����в�����NO2������Ա�Na2O2ֱ�����գ����״����672mlNO2���Ա�______g Na2O2���ա�NO2���ŷŻ�����һϵ�еĻ������⣬��дһ��������Ļ������⣺_____________ ��
���𰸡�In(OH)3 + 3H+ = In3+ + 3H2O ����Ũ�� ��ȴ�ᾧ ���� In3+ + 3e- = In 4In(NO3)3![]() 2In2O3+12NO2��+3O2�� 4 0.05 1.17 �⻯ѧ����������������
2In2O3+12NO2��+3O2�� 4 0.05 1.17 �⻯ѧ����������������
��������
����Ҫ�ɷ�ΪIn(OH)3��ˮ�����ܽ���ϡ���ᣬ��������к�ԭ���õ�����������Һ������Һ����Ũ������ȴ�ᾧ�����˲�ϴ�ӡ�����õ����������壬�����þ�����ϡ�����Ϻ���ɵõ�����������NaOH��ҺΪ���Һ�����д��������õ��ߴ�������ߴ����ܽ���ϡ���ᣬ��ͨ�����ȴٽ��������ֽ�ɵõ�In2O3���ݴ˷������
(1)In(OH)3�ܽ���ϡ���ᣬ������Ӧ�����ӷ���ʽΪIn(OH)3+3H+=In3++3H2O���ʴ�Ϊ��In(OH)3+3H+=In3++3H2O��
(2)������������Һ�л������������ķ���������Ũ������ȴ�ᾧ�����ˡ�ϴ�Ӻ���ʴ�Ϊ������Ũ������ȴ�ᾧ��
(3)��⾫�������ᴿʱ������Ϊ������������In3+������ԭ��Ӧ���缫��ӦʽΪIn3++3e-=In���ʴ�Ϊ��������In3++3e-=In��
(4)�����������ֽ⣬����Ϊ������������������������������Ӧ�ķ���ʽΪ��4In(NO3)3 ![]() 2In2O3+12NO2��+3O2�����ʴ�Ϊ��4In(NO3)3
2In2O3+12NO2��+3O2�����ʴ�Ϊ��4In(NO3)3 ![]() 2In2O3+12NO2��+3O2����
2In2O3+12NO2��+3O2����
(5)������ӦIn2O3+CO2InO+CO2��ƽ�ⳣ��K=![]() =0.25������ͬһ�����У������Ũ��֮�ȵ������ʵ���֮�ȣ�
=0.25������ͬһ�����У������Ũ��֮�ȵ������ʵ���֮�ȣ�![]() =
=![]() =4���ʴ�Ϊ��4��
=4���ʴ�Ϊ��4��
��.0.02mol��In2O3(s)�ڷ�Ӧ�ﵽƽ��ʱת����Ϊ50%����֪�μӷ�Ӧ��In2O3������Ϊ0.01mol��ͬʱ�μӷ�Ӧ��CO�����ɵ�CO2�����ʵ���ҲΪ0.01mol���ݢ�֪ƽ��ʱ![]() =4����
=4����![]() =4����ã�x=0.05mol���ʴ�Ϊ��0.05mol��
=4����ã�x=0.05mol���ʴ�Ϊ��0.05mol��
(6)672mLNO2��������ʵ���Ϊ![]() =0.03mol����nmolNa2O2ֱ�����գ�����ݵ����غ㣺0.03mol��1=nmol��2����ã�n=0.015mol��Na2O2������Ϊ0.015mol��78g/mol=1.17g������NO2�����ŵ������У�����ɹ⻯ѧ���������������꣬�ʴ�Ϊ��1.17���⻯ѧ���������������ꡣ
=0.03mol����nmolNa2O2ֱ�����գ�����ݵ����غ㣺0.03mol��1=nmol��2����ã�n=0.015mol��Na2O2������Ϊ0.015mol��78g/mol=1.17g������NO2�����ŵ������У�����ɹ⻯ѧ���������������꣬�ʴ�Ϊ��1.17���⻯ѧ���������������ꡣ

����Ŀ����ȩ��ľ�ļӹ���ҽҩ�ȷ�������Ҫ��;���״�ֱ�������ǹ�ҵ�Ϻϳɼ�ȩ���·������Ʊ������漰����Ҫ��Ӧ���£�
��ӦI��CH3OH(g)![]() HCHO(g)+H2(g) ��H1=+85.2kJ��mol��1
HCHO(g)+H2(g) ��H1=+85.2kJ��mol��1
��ӦII��CH3OH(g)+1/2O2(1)![]() HCHO(g)+H2O(g) ��H2
HCHO(g)+H2O(g) ��H2
��ӦIII��H2(g)+1/2O2(g)![]() H2O(g) ��H3=��241.8kJ��mol��1
H2O(g) ��H3=��241.8kJ��mol��1
����Ӧ��
��ӦIV��CH3OH(g)+O2(g)![]() CO(g)+2H2O(g) ��H4=��393.0kJ��mol��1
CO(g)+2H2O(g) ��H4=��393.0kJ��mol��1
��1�����㷴Ӧ���ķ�Ӧ����H2=____________________________________________��
��2��750K�£��ں����ܱ������У�������ӦCH3OH(g)![]() HCHO(g)+H2(g��������ʼѹǿΪP0���ﵽƽ��ת����Ϊ������ƽ��ʱ����ѹǿPƽ=___________(�ú�P0������ʽ�ӱ�ʾ)����P0=101kPa�������=50.0%�����㷴Ӧƽ�ⳣ��Kp=___________kPa(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������������������Ӧ)��
HCHO(g)+H2(g��������ʼѹǿΪP0���ﵽƽ��ת����Ϊ������ƽ��ʱ����ѹǿPƽ=___________(�ú�P0������ʽ�ӱ�ʾ)����P0=101kPa�������=50.0%�����㷴Ӧƽ�ⳣ��Kp=___________kPa(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������������������Ӧ)��
��3��Na2CO3�Ǽ״������Ƽ�ȩ�Ĵ��������о�ָ��������Ӧ�IJ��ֻ������£�
����i��CH3OH��H+��CH2OH
����������CH2OH����H+HCHO
����������CH2OH��3��H+CO
����iv����H+��H��H2
��ͼ��ʾһ���������¶ȶ�̼���ƴ��������ܵ�Ӱ�죬�ش��������⣺

�ٴ�ƽ��ǶȽ���550��-650���״����ɼ�ȩ��ת�������¶����ߵ�ԭ��___________��
�ڷ�Ӧ����i�Ļ��___________(����>����<������=��)CH3OH(g)![]() HCHO(g)+H2(g)��ܡ�
HCHO(g)+H2(g)��ܡ�
��650��~750������Ӧ����ii������___________(����>������<������=��)��Ӧ�����������ʡ�
��4�������Ǵ�����ȩ��ˮ��һ�ֹ��գ��������ʿ��÷���v=0.0423c(mg��L��1��h��1)��ʾ(����cΪ��ȩŨ��)���±�Ϊ�����¼�ȩ��Ũ���洵��ʱ��仯���ݡ�
Ũ��(mg/L) | 10000 | 8000 | 4000 | 2000 | 1000 |
����ʱ��(h) | 0 | 7 | 23 | 39 | 55 |
��ȩŨ��Ϊ2000mg/Lʱ���䴵������v=___________ mg��L��1��h��1�������ϱ����ݣ���ʼŨ��Ϊ10000mg/L������ȩŨ�Ƚ�Ϊ5000mg/L������ʱ��Ϊ___________h��