题目内容
【题目】高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )
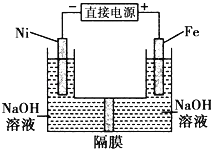
A.Fe电极是阳极,电极反应为Fe﹣6e﹣+4H2O═FeO42﹣+8H+
B.电解时电子流向:负极→Ni→电解液→Fe电极→正极
C.若隔膜为阴离子交换膜,则电解结束偶左侧溶液中含有FeO42﹣
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜,溶液混合后,与原溶液相比,阴极区pH减小
【答案】D
【解析】
A. Fe电极是阳极,根据电解液得到电极反应为Fe 6e- + 8OH- = FeO42 + 4H2O,故A错误;
B. 电解时电子流向:负极→Ni,Fe电极→正极,电子不能经过电解液,故B错误;
C. 若隔膜为阴离子交换膜,根据电解池“异性相吸”原则,OH-不断向阳极即向右侧移动,电解结束后右侧溶液中含有FeO42,左侧不含FeO42,故C错误;
D. 电解时阳极区OH-不断消耗,因此pH降低,阴极区OH-不断生成,pH升高,撤去隔膜,溶液混合后,与原溶液相比,阴极区碱性减弱,pH减小,故D正确。
综上所述,答案为D。

练习册系列答案
相关题目