题目内容
【题目】Ⅰ.饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在。
(1)砷与磷为同一主族元素,砷的原子序数为________________。
(2)根据元素周期律,下列说法正确的是__________________。
a.酸性: H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______。
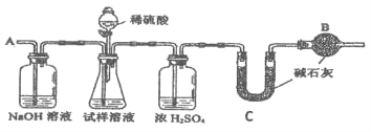
Ⅱ.(4)A、B、C、X是中学化学常见的物质,A、B、C均由短周期元素组成,转化关系如图:
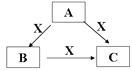
若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素为________(写元素名称),它在周期表中的位置为______。
②该金属元素的单质与某氧化物在高温下反应,常用于焊接铁轨及定向爆破,该反应的化学方程式为________。
Ⅲ.铁及其化合物在生活中有广泛应用。
(5)Fe3+基态核外电子排布式为______。
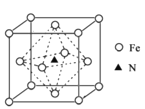
(6)氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为______。
(7)某铁的化合物结构简式如图所示:
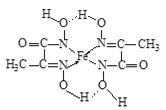
①上述化合物中所含有的非金属元素的电负性由大到小的顺序为______(用元素符号表示)。
②上述化合物中氮原子的杂化方式为______。
【答案】33 ac 4FeS2+15O2+14H2O=4Fe(OH)3+8SO42-+16H+ 铝 第三周期第ⅢA族 2Al+Fe2O3 ![]() 2Fe+Al2O3 1s22s22p63s23p63d5 4∶1 O>N>C>H sp2、sp3
2Fe+Al2O3 1s22s22p63s23p63d5 4∶1 O>N>C>H sp2、sp3
【解析】
(1)磷原子核外电子数为15,砷与磷为同一主族元素,则砷的原子序数15+18=33,故答案为:33;
(2)a.同周期自左而右,非金属性增强,最高价氧化物对应水化物酸性增强,同主族自上而下,非金属性减弱,最高价氧化物对应水化物酸性减弱,酸性:H2SO4>H3PO4>H3AsO4,故a正确;b.同周期自左而右原子半径减小,同主族自上而下原子半径依次增大,原子半径:As>P>S,故b错误;c.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性:S>P>As,故c正确;故答案为:ac;
(3)FeS2水溶液中被O2氧化生成硫酸、氢氧化铁,反应的离子方程式为:4FeS2+15O2+14H2O=4Fe(OH)3+8SO42-+16H+,故答案为:4FeS2+15O2+14H2O=4Fe(OH)3+8SO42-+16H+;
Ⅱ.(4)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,则C为偏铝酸根,将A、C的水溶液混合可得B的白色胶状沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,x为氢氧化钠。
①A、B、C中含有的同一种常见金属元素为铝,它在周期表中的位置为第三周期第ⅢA族,故答案为:铝;第三周期第ⅢA族;
②铝与氧化铁在高温下反应生成氧化铝和铁,常用于焊接铁轨及定向爆破,该反应的化学方程式为2Al+Fe2O3 ![]() 2Fe+Al2O3,故答案为:2Al+Fe2O3
2Fe+Al2O3,故答案为:2Al+Fe2O3 ![]() 2Fe+Al2O3;
2Fe+Al2O3;
Ⅲ.(5)Fe是26号元素,核外电子排布式为1s22s22p63s23p63d64s2,先失去4s能级2个电子、再失去3d能级1个电子形成Fe3+,Fe3+基态核外电子排布式为1s22s22p63s23p63d5,故答案为:1s22s22p63s23p63d5;
(6)氮化铁晶体中:氮原子位于体内,只有1个,铁原子个数为:8×![]() +6×
+6×![]() =4个,所以该晶体中铁、氮的微粒个数之比为4∶1;故答案为:4∶1;
=4个,所以该晶体中铁、氮的微粒个数之比为4∶1;故答案为:4∶1;
(7)①同周期从左向右,电负性逐渐增大,非金属性越强,电负性越大,故电负性大小为O>N>C>H,故答案为:O>N>C>H;
②化合物中形成C=N双键的N原子形成2个σ键,含有1对孤电子对,而形成单键的N原子,形成2个σ键,含有2对孤电子对,杂化轨道数目分别为3、4,N原子采取sp2、sp3杂化,故答案为:sp2、sp3。

 优翼小帮手同步口算系列答案
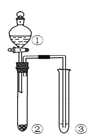
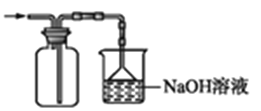
优翼小帮手同步口算系列答案【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D