题目内容
【题目】某校化学小组的同学开展了一系列的化学实验活动。
请你参与实验并完成下列问题:
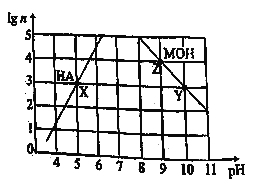
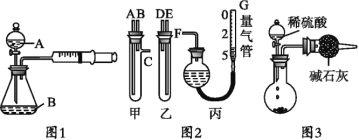
(1)甲同学用图1所示装置,测量锌与硫酸反应速率:把2 g 锌粒放入锥形瓶内,通过分液漏斗加入1 mol·L-1稀硫酸40 mL,收集10 mL气体,通过记录______得到反应速率为x mol·(L·min)-1。实验开始时检查该装置气密性的方法是_____。
①甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,则固体混合物和稀硫酸应分别置于___、__仪器中(填仪器编号);
②G管可以用化学实验室里的一种常用仪器来替代,这种仪器的名称是___;
③仪器甲、乙接口的连接方式如下:A连接__,B连接___,C连接___(填写各接口的编号);
④为提高测量的准确性,收集完气体后,丙装置读数前应进行的操作是____。
(3)丙同学与甲同学实验目的相同:用图3装置测定生成的CO2的质量,但该装置存在明显缺陷,从而导致实验误差___,请你分析其中使测定结果可能偏大的主要原因___。
【答案】反应时间 关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,若活塞能回到原位,证明不漏气,否则漏气 甲 乙 碱式滴定管 D E F 上下移动滴定管,使左右两边液面相平 偏大 CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中
【解析】
(1)根据速率的表达式![]() 气判断需要测量数据,通过分液漏斗加入l mol·L-1稀硫酸40mL ,收集10mL气体可计算硫酸浓度变化,故还需知道反应时间;使装置内外形成气压差是气密性检查的常用手段,检查该装置的气密性可关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好,
气判断需要测量数据,通过分液漏斗加入l mol·L-1稀硫酸40mL ,收集10mL气体可计算硫酸浓度变化,故还需知道反应时间;使装置内外形成气压差是气密性检查的常用手段,检查该装置的气密性可关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好,
因此,本题答案是:反应时间;关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好;
(2)①由图装置可以知道甲有c支管应为生产气体装置,则甲应放入Na2CO3、NaCl的固体混合物,乙放入硫酸,因此,本题答案是:甲;乙;
②G为量气装置,根据构造,可用碱式滴定管代替,因此,本题答案是:碱式滴定管;
③连接导管时,应用A连接D,B连接E,C连接F,因此,本题答案是:D、E、F;
④读数时应使装置内外气压相等,读数前应上下移动滴定管,使左右两边液面相平;因此,本题答案是:上下移动滴定管,使左右两边液面相平;
(3)丙同学的实验中:因生产的CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中,会导致质量偏大,因此,本题答案是:CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中。

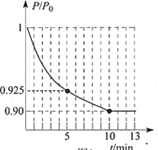
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
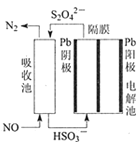
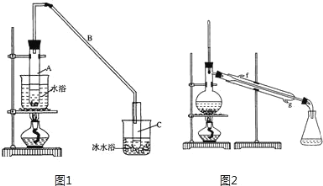
【题目】某化学小组采用如图装置,以环己醇制备环己烯:
已知: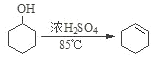 +H2O
+H2O
密度(g/cm3) | 熔点(℃) | 沸点(℃ | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
已知:温度高于100℃时,原料环己醇易和水形成共沸物一起被蒸出反应体系。
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①如图1导管B的作用是______。
②加热试管A采用热水浴,而非直接加热,目的是______,试管C置于冰水浴中的目的是______。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等,加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用______(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液 D.溴水或溴的四氯化碳溶液
②再将环己烯按图2装置蒸馏,冷却水从______口进入(填“上”或“下”)。
③收集产品时,如何判断锥形瓶中收集到的为环己烯。实验制得的环己烯精品质量低于理论产量,可能的原因是______。
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)制环己烯时,由于浓硫酸的强氧化性,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验![]() 、SO2、CO2及水蒸气,混合气体通过试剂的顺序是______(填序号,试剂可重复使用)
、SO2、CO2及水蒸气,混合气体通过试剂的顺序是______(填序号,试剂可重复使用)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液