题目内容
10.100g浓度为18mol/L密度为ρg/mL的浓硫酸中加入一定的水稀释成9mol/L的硫酸,则加入水的体积为( )| A. | 小于100mL | B. | 等于100mL | C. | 大于100mL | D. | 等于100/ρmL |
分析 溶液在稀释前后溶质的质量不变,硫酸的浓度越大,密度越大,质量分数w越大,据此结合c=$\frac{1000ρω}{M}$列式计算即可,注意水的密度与硫酸的密度小.
解答 解:稀释前后溶质的质量不变,设加水的质量为x,稀释前的质量分数为w1,稀释后的质量分数为w2,
则:100g×w1=(100g+x)×w2,
18mol•L-1的浓硫酸加到一定量的水中稀释成9mol•L-1的硫酸,
由c=$\frac{1000ρω}{M}$可得:c1=$\frac{1000{ρ}_{1}{w}_{1}}{M}$=18mol/L=2c2=$\frac{1000{ρ}_{2}{w}_{2}}{M}$×2,
硫酸的浓度越大,密度越大,则ρ1>ρ2,$\frac{{w}_{1}}{{w}_{2}}$=2×$\frac{{ρ}_{2}}{{ρ}_{1}}$<2,
所以:$\frac{100+x}{100}$=$\frac{{w}_{1}}{{w}_{2}}$<2,
解得:x<100g,
又水的密度约为1g/mL,
则加水的体积小于100mL,
故选A.
点评 本题考查物质的量浓度的计算,题目难度中等,注意掌握物质的量浓度及表达式,明确物质的量浓度与溶质质量分数的关系为解答关键.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
20.在水溶液中能大量共存,加入过量的稀H2SO4后有沉淀和气体产生的离子组是( )
| A. | HCO3-,Cl-,Na+,Ba2+ | B. | AlO2-,S2-,Na+,K+ | ||
| C. | SiO32-,Cl-,K+,Na+ | D. | Ba2+,Al3+,NO3-,Cl- |
1.恒温时,在一容积固定的容器中充入2mol的NO2,反应2NO2(g)?N2O4(g) 达到平衡时,向容器入通入2mol的NO2,重新达到平衡后,与第一次平衡时相比,NO2的转化率( )
| A. | 不变 | B. | 增大 | C. | 减少 | D. | 无法确定 |
18.有文献记载:在强碱条件下,加热银氨溶液可能析出银镜.某同学进行如表验证和对比实验.
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料:
a.Ag(NH3)2++2H2O?Ag++2NH3H2O
b.AgOH不稳定,极易分解为黑色Ag2O
(1)配制银氨溶液所需的药品是2%硝酸银,2%稀氨水.
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.
①用湿润的红色石蕊试纸检验NH3产生的现象是红色石蕊试纸变蓝.
②产生Ag2O的原因是水浴加热,促使NH3•H2O分解成氨气逸出,使得可逆反应平衡右移,促进了银氨络离子向银离子的转化,银离子和氢氧根离子反应生成氢氧化银,AgOH不稳定,水浴加热分解为黑色Ag2O.
(3)该同学对产生银镜的原因提出假设:可能是NaOH还原Ag2O.实验及现象:向AgNO3溶液中加入过量NaOH溶液,出现黑色沉淀,水浴加热,未出现银镜.
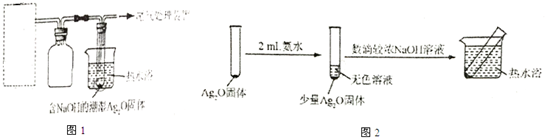
(4)重新假设:在NaOH存在下可能是NH3还原Ag2O.用如图1所示装置进行实验,现象:出现银镜.在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略).
(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成,由此又提出假设:在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3还原Ag2O的反应.进行如图2实验:
①有部分Ag2O溶解在氨水中,该反应的化学方程式是Ag2O+4NH3•H2O=2Ag(NH3)2OH+3H2O.
②实验结果证实假设成立,依据的现象是与溶液接触的试管壁上析出银镜.
③用HNO3清洗试管壁上的Ag,该反应的化学方程式是2HNO3(浓)+Ag═AgNO3+2NO2↑+H2O.
| 装置 | 实验序号 | 试管中的药品 | 现象 |
 | 实验Ⅰ | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生,一段时间后,溶液逐渐变黑,试管壁附着银镜 |
| 实验Ⅱ | 2mL银氨溶液和数滴较浓氨水 | 有气泡产生,一段时间后,溶液无明显变化 |
a.Ag(NH3)2++2H2O?Ag++2NH3H2O
b.AgOH不稳定,极易分解为黑色Ag2O
(1)配制银氨溶液所需的药品是2%硝酸银,2%稀氨水.
(2)经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O.
①用湿润的红色石蕊试纸检验NH3产生的现象是红色石蕊试纸变蓝.
②产生Ag2O的原因是水浴加热,促使NH3•H2O分解成氨气逸出,使得可逆反应平衡右移,促进了银氨络离子向银离子的转化,银离子和氢氧根离子反应生成氢氧化银,AgOH不稳定,水浴加热分解为黑色Ag2O.
(3)该同学对产生银镜的原因提出假设:可能是NaOH还原Ag2O.实验及现象:向AgNO3溶液中加入过量NaOH溶液,出现黑色沉淀,水浴加热,未出现银镜.
(4)重新假设:在NaOH存在下可能是NH3还原Ag2O.用如图1所示装置进行实验,现象:出现银镜.在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略).
(5)该同学认为在(4)的实验中会有Ag(NH3)2OH生成,由此又提出假设:在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3还原Ag2O的反应.进行如图2实验:
①有部分Ag2O溶解在氨水中,该反应的化学方程式是Ag2O+4NH3•H2O=2Ag(NH3)2OH+3H2O.
②实验结果证实假设成立,依据的现象是与溶液接触的试管壁上析出银镜.
③用HNO3清洗试管壁上的Ag,该反应的化学方程式是2HNO3(浓)+Ag═AgNO3+2NO2↑+H2O.

15.下列叙述中,错误的是( )
| A. | 乙烷与氯气在光照下反应只生成一氯乙烷 | |
| B. | 苯在合适条件下催化加氢可生成环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 苯与浓硝酸、浓硫酸共热并保持50-60℃反应生成硝基苯 |
2.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6KCl+8H2O.对于该反应,下列说法正确的是( )
| A. | 该反应是置换反应 | |
| B. | 该反应只有K2FeO4为氧化产物 | |
| C. | 3mol氯气参与反应转移电子数为6个 | |
| D. | 该反应条件下K2FeO4的氧化性大于Cl2 |
 (填“向左”、“向右”或“不”).
(填“向左”、“向右”或“不”).