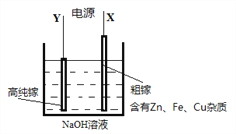
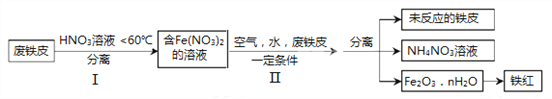
题目内容
【题目】黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),制备黄血盐的一种工艺如下:
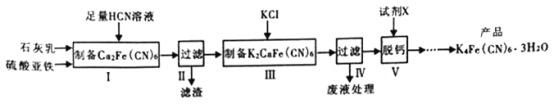
回答下列问题:
(1)实验室用绿矾晶体配制硫酸亚铁溶液时,为了防止其变质需要添加的试剂为__________________。
(2)步骤Ⅱ中滤渣的主要成分是_______________,步骤Ⅴ所用的试剂X可以是________________。
(3)步骤Ⅲ反应的化学方程式为_______________________________________。
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。25℃时,Ka(HCN) =6.25×10-10。
①HCN的电子式为__________________。
②25℃时,反应CN-+H2O![]() HCN+OH-的平衡常数K=_____________________。
HCN+OH-的平衡常数K=_____________________。
③含CN-废水的处理方法之一是:pH控制在11左右,用氯气将废水中CN-氧化成CO2和N2,该反应的离子方程式为_____________________________________。
(5)近日,一条“盐里面加进了亚铁氰化钾”危害身体健康的信息在网上流传。已知K4Fe(CN)6![]() 4KCN+FeC2+N2↑,氰化钾的半数致死量(LD50)为6.4 mg·kg-1 (即每1kg体重6.4 mg),我国卫生部规定食盐中黄血盐的最大使用量为10 mg·kg-1。假设烹饪过程中黄血盐发生上述分解,一名60Kg男子每天摄入60g食盐是否达到氰化钾的半数致死量?_________________________________。(列式计算说明)。
4KCN+FeC2+N2↑,氰化钾的半数致死量(LD50)为6.4 mg·kg-1 (即每1kg体重6.4 mg),我国卫生部规定食盐中黄血盐的最大使用量为10 mg·kg-1。假设烹饪过程中黄血盐发生上述分解,一名60Kg男子每天摄入60g食盐是否达到氰化钾的半数致死量?_________________________________。(列式计算说明)。
【答案】 铁粉、稀硫酸 CaSO4 K2CO3 Ca2Fe(CN)6+2KCl=K2CaFe(CN)6↓+ CaCl2 ![]() 1.6×10-5 5Cl2+2CN-+8OH-=10Cl-+N2+2CO2+4H2O
1.6×10-5 5Cl2+2CN-+8OH-=10Cl-+N2+2CO2+4H2O ![]() =7.06×10-3mg·kg-1< 6.4 mg·kg -1,不能达到氰化钾的半数致死量
=7.06×10-3mg·kg-1< 6.4 mg·kg -1,不能达到氰化钾的半数致死量
【解析】(1)实验室用绿矾晶体配制硫酸亚铁溶液时,为了防止其氧化变质,应该加入铁粉,为了抑制其水解应该加入稀硫酸。
(2)步骤Ⅱ中滤渣主要是反应中生成的CaSO4沉淀。步骤V的作用是将残留的钙离子沉淀除去,所以应该使用能较好的沉淀钙离子的试剂,考虑到最后得到的是钾盐,所以试剂X碳酸钾。
(3)步骤Ⅲ是向上面得到的Ca2Fe(CN)6溶液中加入KCl得到K2CaFe(CN)6沉淀,反应的方程式为:Ca2Fe(CN)6+2KCl=K2CaFe(CN)6↓+ CaCl2。
(4)①H应该形成一个共价键,C应该形成四个共价键,N应该形成三个键,所以HCN的结构式为H-C≡N,所以其电子式为![]() 。
。
②CN-+H2O![]() HCN+OH-是CN-的水解反应,水解反应的平衡常数K应该等于KW与电离平衡常数的比值,所以K=KW/ Ka(HCN)=1×10-14/6.25×10-10=1.6×10-5。
HCN+OH-是CN-的水解反应,水解反应的平衡常数K应该等于KW与电离平衡常数的比值,所以K=KW/ Ka(HCN)=1×10-14/6.25×10-10=1.6×10-5。
③氯气将废水中CN-氧化成CO2和N2,本身被还原为氯离子,溶液显碱性,所以在反应物中添加氢氧根离子,所以方程式为:5Cl2+2CN-+8OH-=10Cl-+N2+2CO2+4H2O(注意:CN-中C为+2价,N为-3价,所以一个CN-化合价升高5价)
(5)60g食盐中含有的黄血盐为60g×10-3kg·g-1×10mg·kg1,黄血盐的分子量为368,所以得到黄血盐的物质的量为60g×10-3kg·g-1×10mg·kg1/368,分解得到的KCN的物质的量是黄血盐物质的量的4倍,KCN 的分子量为65,所以得到的KCN的质量为4×65×60g×10-3kg·g-1×10mg·kg1/368(此时单位为mg),男子体重为60kg,得到每1kg体重摄入的KCN为:![]() =7.06×10-3mg·kg-1< 6.4 mg·kg -1,所以不能达到氰化钾的半数致死量。
=7.06×10-3mg·kg-1< 6.4 mg·kg -1,所以不能达到氰化钾的半数致死量。

 考前必练系列答案
考前必练系列答案