题目内容
【题目】根据有关知识回答下列问题
(1)25℃时,0.1 molL-1的一元酸HA溶液中c(H+)=1.0×10-4 molL-1,请回答下列问题:此时溶液的pH=_______,HA是________酸(填“强”或“弱”)。
(2)现有NaHCO3、NaHSO3、NaHSO4三种常见的酸式盐,它们在工业生产和日常生活中有着广泛的应用。请回答有关问题:
①25℃时,NaHCO3的水溶液显_____性(填“酸”或“碱”)。
②25℃时,物质的量浓度均为0.01 molL-1的三种酸式盐溶液,pH最小是_________。
(3)向50ml 0.018molL-1的AgNO3溶液中加入50m1 0.020molL-1的盐酸生成AgCl沉淀。已知该温度下Ksp(AgCl)=1.0×10﹣10,忽略溶液的体积变化,完全沉淀后,溶液中c(Ag+)=__molL-1。
(4)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(杂质不参与反应)。
实验步骤:准确称取1g Na2C2O4固体样品,配制成100mL溶液,取出20.00mL于锥形瓶中。再向锥形瓶中加入足量稀H2SO4溶液,用0.016 molL-1高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在_______滴定管中.(填“酸式”或“碱式”)。
②滴定至终点时的实验现象是:__________________________________________。
③下列操作可能使测量结果偏高的是__________。
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算样品中Na2C2O4的纯度______________。
【答案】 4 弱 碱 NaHSO4 1.0×10—7 酸式 滴加最后一滴酸性高锰酸钾溶液,溶液突然由无色变为淡红色,且30s内不褪色 B 67%
【解析】本题主要考查化学反应原理综合试题。
(1)此时溶液的pH=4>1,HA是弱酸。
(2)①25℃时,NaHCO3的水溶液显碱性。
②25℃时,物质的量浓度均为0.01 molL-1的三种酸式盐溶液,由于HSO4-完全电离,而HSO3-、HCO3-难电离,所以pH最小的是NaHSO4。
(3)反应后c(Cl-)=0.001molL-1, Ksp(AgCl)=1.0×10﹣10,忽略溶液的体积变化,完全沉淀后,溶液中c(Ag+)=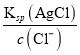 =1.0×10﹣7molL-1。
=1.0×10﹣7molL-1。
(4)①为了防止高锰酸钾腐蚀橡胶管,高锰酸钾溶液应装在酸式滴定管中。
②滴定至终点时的实验现象是:加最后一滴酸性高锰酸钾溶液,溶液突然由无色变为淡红色,且30s内不褪色。
③A.Na2C2O4溶液被稀释,消耗高锰酸钾溶液体积减小,使测量结果偏低;B.高锰酸钾溶液体积数值增大,使测量结果偏高;C.初读数偏大,终读数偏小,高锰酸钾溶液体积数值减小,使测量结果偏低;D.不影响测量结果。故选B。
④样品中Na2C2O4的纯度为5×2.5×0.016 molL-1×0.025L×134g/mol/1g=67%。