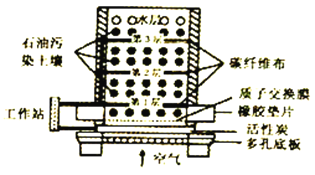
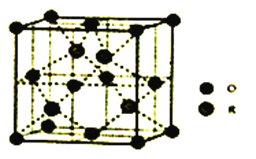
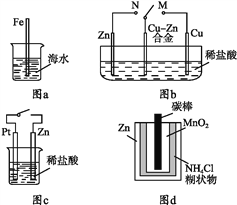
题目内容
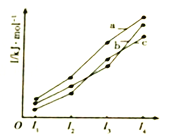
【题目】25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)二者所占物质的量分数(a)随溶液pH变化的关系如图所示。下列说法错误的是
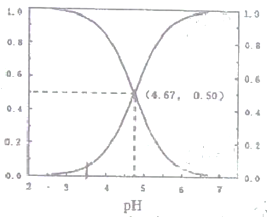
A. pH<4.67的溶液中:c(CH3COO-)<c(CH3COOH)
B. pH=7的溶液中:c(CH3COOH)=0,c(CH3COO-)=1.0
C. 在pH=4.67的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(0H-)
D. pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1
【答案】B
【解析】根据图中信息可知,随着pH增大, c(CH3COOH)增大,c(CH3COO-)减小,当pH<4.67时,c(CH3COO-)<c(CH3COOH),选项A正确;B、醋酸的电离平衡和醋酸钠的水解平衡均为可逆的,反应不可能彻底,故pH=7的溶液中:c(CH3COOH) ![]() 0
0![]() 0,c(CH3COO-)
0,c(CH3COO-)![]() 1.0,选项B错误;C、在pH=4.67的溶液中c(CH3COO-)=c(CH3COOH),由电荷守恒可知,c(Na+)+c(H+)= c(CH3COO-)+ c(OH-)= c(CH3COOH)+ c(OH-),选项C正确;D、pH=3.5溶液中c(Na+)+c(H+)= c(CH3COO-)+ c(OH-),再把题干中的c(CH3COOH)+c(CH3COO-)=0.1molL-1代入即可得c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 molL-1,选项D正确。答案选B。
1.0,选项B错误;C、在pH=4.67的溶液中c(CH3COO-)=c(CH3COOH),由电荷守恒可知,c(Na+)+c(H+)= c(CH3COO-)+ c(OH-)= c(CH3COOH)+ c(OH-),选项C正确;D、pH=3.5溶液中c(Na+)+c(H+)= c(CH3COO-)+ c(OH-),再把题干中的c(CH3COOH)+c(CH3COO-)=0.1molL-1代入即可得c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 molL-1,选项D正确。答案选B。

练习册系列答案
相关题目