题目内容
【题目】下列有关热化学方程式的叙述,正确的是
A.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
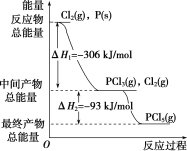
B.由N2O4(g)![]() 2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
C.由:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量为57.3 kJ
D.已知101kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221kJ/mol,则1 mol碳完全燃烧放出的热量大于110.5kJ
【答案】D
【解析】
A.燃烧热指的是1mol的可燃物完全燃烧生成稳定的氧化物时所放出的热量,而对于水来讲,液态的水才是稳定的状态,A错误;
B.N2O4(g)![]() 2NO2(g) △H=-56.9kJ·mol-1,表明1mol的四氧化二氮完全反应生成2mol的二氧化氮时才能放出56.9kJ的热量,但这是一个可逆反应,完全反应是不可能的,因此B错误;
2NO2(g) △H=-56.9kJ·mol-1,表明1mol的四氧化二氮完全反应生成2mol的二氧化氮时才能放出56.9kJ的热量,但这是一个可逆反应,完全反应是不可能的,因此B错误;
C.一般来讲,中和热是指稀的强酸与稀的强碱反应生成1mol水的时候所放出的热量,但是对于醋酸来讲,是弱电解质,电离的过程要吸收热量,因此1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量要小于57.3 kJ,C错误;
D.碳完全燃烧时,生成的是二氧化碳,肯定比生成一氧化碳时放出的热量要多,D正确。
故答案选D。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】某同学用标准NaOH溶液来测定未知浓度的盐酸的浓度:
(1)先配制250mL 0.5mol/L的NaOH标准溶液所需的称量的质量NaOH为________ g,
需要的主要玻璃仪器有玻璃棒、量烧杯、胶头滴管、量筒和___________。
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用NaOH溶液滴定到终点。在锥形瓶的待测液中滴加2~3滴酚酞试液,并开始滴定。
手眼:左手控制滴定管活塞,右手摇动锥形瓶,眼睛____________;
滴速:先快后慢,当接近终点时,应一滴一摇。滴定终点的判断:___________,即到终点,读出体积并记录数据。
(3)该同学进行了三次实验,实验数据如下表:
实验编号 | 盐酸的体积(mL) | 标准NaOH溶液的体积(mL) |
① | 均是20.00 | 16.90 |
② | 17.10 | |
③ | 18.20 |
滴定中误差较大的是第______次实验。造成这种误差的可能原因是__________(填选项编号)
a.滴定管在盛装标准NaOH溶液前未润洗
b.在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
c.达到滴定终点时,俯视溶液凹液面最低点读数
d.滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f.滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
(4)该同学所测得盐酸的物质的量浓度为_________。(结果保留三位小数)。
【题目】从下列事实所得出的解释或结论正确的是
选项 | 实验事实 | 解释或结论 |
A | 已知 | 金刚石比石墨稳定 |
B |
| 这是一个熵增反应 |
C | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的转化率一定增大 |
D | 用醋酸作导电性实验时,灯泡很暗 | 说明醋酸是弱酸 |
A.AB.BC.CD.D