题目内容
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程中的能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。
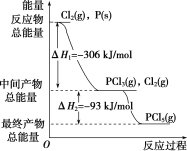
根据如图回答下列问题:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式是________________________________________________________。
(2)PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式是_____________________。
(3)P(s)和Cl2(g)分两步反应生成1 mol PCl5(g)的ΔH3=____,P(s)和Cl2(g)一步反应生成1 mol PCl5(g)的ΔH4____(填“大于”“小于”或“等于”)ΔH3。
(4)已知1mol白磷变成1mol红磷放出18.39KJ的热量和下列两个热化学方程式:
4P(白磷,s)+5O2(g)=2P2O5(s) ΔH1,
4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2。
则ΔH1和ΔH2的关系正确的是(______)
A.ΔH1=ΔH2 B.ΔH1>ΔH2 C.ΔH1<ΔH2 D.无法确定
【答案】P(s)+3/2Cl2(g)═PCl3(g)△H=-306 kJ/mol PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJmol-1 -399kJmol-1 等于 C
【解析】
(1)根据图象得出反应物、生成物以及反应热=生成物的总能量-反应物的总能量,然后依据书写热化学方程式的原则书写;
(2)根据图象得出反应物、生成物以及反应热=生成物的总能量-反应物的总能量,然后依据书写热化学方程式的原则书写;
(3)根据盖斯定律分析,根据反应物的总能量、中间产物的总能量以及最终产物的总能量,结合化学方程式以及热化学方程式的书写方法解答,注意盖斯定律的应用;
根据盖斯定律的实质应用判断,可以利用题干所给反应和热量变化,合并得到白磷转化为红磷的热量变化分析判断。
(1)根据图示可知:P(s)+3/2Cl2(g)═PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,则热化学方程式为:P(s)+
3/2Cl2(g)═PCl3(g)△H=-306 kJ/mol,
故答案为:P(s)+3/2Cl2(g)═PCl3(g)△H=-306 kJ/mol;
(2)根据图示可知:Cl2(g)+PCl3(g)═PCl5(g),中间产物的总能量大于最终产物的总能量,该反应是放热反应,△H=生成物总能量-反应物总能量=-93 kJ/mol;所以PCl5(g)═PCl3(g)+Cl2(g)是吸热反应;热化学方程式为PCl5(g)═PCl3(g)+Cl2(g)△H=+93 kJ/mol,
故答案为:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJmol-1;
(3)根据盖斯定律,P和Cl2分两步反应和一步反应生成PCl5的△H应该是相等的,P和Cl2分两步反应生成1 molPCl5的热化学方程式:
P(s)+3/2Cl2(g)═PCl3(g)△H1=-306 kJ/mol,
Cl2(g)+PCl3(g)═PCl5(g)△H2=-93 kJ/mol;
P和Cl2一步反应生成1molPCl5的△H3=-306 kJ/mol+(-93 kJ/mol)=-399 kJ/mol,
由图象可知,P和Cl2分两步反应生成1molPCl5的△H3=-306kJ/mol-(+93kJ/mol)=399kJ/mol,根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等,则P和Cl2一步反应生成1molPCl5的反应热等于P和Cl2分两步反应生成1molPCl5的反应热,
故答案为:-399kJmol-1;等于;
(4)①4P(白磷,s)+5O2(g)=2P2O5(s) ΔH1,
②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2。
①②得到4P(白)=4P(红)△H=△H1△H2,
已知1mol白磷变成1mol红磷放出18.39KJ的热量,所以△H1△H2<0;△H1<△H2,
故选:C。

【题目】探究![]() 反应的速率影响因素,设计了以下实验。下列说法正确的是
反应的速率影响因素,设计了以下实验。下列说法正确的是
锥形瓶标号 |
| 蒸馏水 |
| 反应温度 | 浑浊出现时间 | 备注 |
1 |
| 0 mL | 10 mL |
| 10s | |
2 | 10mL | 5mL | 5 mL |
| 16 s | |
3 | 10mL | 0mL | 10 mL |
| 5 s | 第10s开始浑浊不再增多 |
4 | 10mL | 4mL |
| 8s |
A.该反应也可通过测![]() 的体积变化来表示化学反应速率的快慢
的体积变化来表示化学反应速率的快慢
B.3号瓶用![]() 来表示速率为
来表示速率为![]()
C.由2号瓶和3号瓶实验结果可得温度越高反应速率越快
D.由1号瓶和4号瓶实验结果可得温度越高反应速率越快
【题目】一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.0~4min的平均反应速率:v(H2O2)>3.3×10-2mol·L-1·min-1
C.反应至6 min时,H2O2分解了50%
D.反应至6 min时,c(H2O2)=0.25 mol/L