题目内容
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2-、碳氢化合物大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:汽车尾气中的CO、NOx、碳氮化合物是大气污染物。使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol K1(该反应的平衡常数)
2C(s)+O2(g)=2CO(g) △H2=-221kJ/mol K2(同上)
C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol K3(同上)
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式_________,以及该热化学方程式的平衡常数K=________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2 △H=-1200kJ/mol。
4CO2+N2 △H=-1200kJ/mol。
①某温度下,在2L密闭容器中充入0.lmolNO和02m1CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时NO2的平均反应速率v(NO2)=_________mol/(L·s)。
②若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为1mol/L、0.4mol/L、0.lmol/L、amol/L,要使反应向逆反应方向进行,a的取值范围_________。
③能使该反应的反应速率增大,且平衡向逆反应方向移动的是_______。
A.及时分离出CO2 B.适当升高温度
C.减小容器体积使体系压强增大 D.选择高效催化剂
(3)电化学降解NO2-的原理如下图:
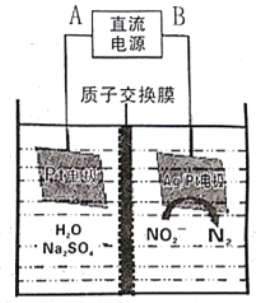
①电源的正极是___(填A或B),阴极反应式为___________。
②若电解过程中转移了3mol电子,则膜两侧电解液的质量变化差![]() 为______g。
为______g。
【答案】 2NO(g)+2CO(g) =N2(g)+2CO2(g) △H= —746.5kJ·mol-1 K=(K32·K1)/K2 0.002 a>25/8(或a>3.125) B A ![]() 16
16
【解析】(1)NO(g) 与CO(g)催化转化成N2(g)和CO2(g)的反应可以由③×2-①-②得到,△H=△H3×2-△H1-△H2=-393.5-180.5-(-221)=-746.5因此热化学方程式为:2NO(g)+2CO(g) =N2(g)+2CO2(g) △H= —746.5kJ·mol-1。此反应的K值也做相应的变换K=K32/K2 .K1
(2)①设达到平衡时CO的浓度改变x,则:
2NO2 + 4CO![]() 4CO2 + N2
4CO2 + N2
起始(mol): 0.1 0.2 0 0
改变(mol): x 2x 2x 1/2x
平衡(mol): 0.1-x 0.2-2x 2x 1/2x
故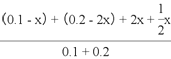 =
=![]() ,解得x=0.02,v(NO2)= 0.02/5×2=0.002mol/(L·s)
,解得x=0.02,v(NO2)= 0.02/5×2=0.002mol/(L·s)
此温度下,某时刻测得NO2、CO、CO2、 N2的浓度分别为1mol/L、0.4mol/L、0.lmol/L、a mol/L,要使反应向逆反应方向进行则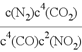 =a×0.14/0.44×12<0.024×0.005/0.042/0.084,解得a>25/8③A.及时分离出CO2 可使平衡向正向移动,反应速率不会增大,A错误。B.适当升高温度,可增大反应速率,此反应是吸热反应,升温逆向移动,B正确。C.减小容器体积使体系压强增大,平衡向气体物质的量减小的方向移动,即正向移动。C错误。D.选择高效催化剂,只改变反应速率,对平衡没有影响,D错误,本题正确选项为B。(3)①根据电化学降解NO2-的原理图可知,Ag/Pt电极上NO2-转化为N2,氮元素化合价从+3价降为0价,被还原,发生还原反应,作为阴极,则电源B为负极,A为正极。阴极反应式为2NO2-+6e-+4H2O=N2↑+8OH-或2NO2-+6e-+8H+=N2↑+4H2O②根据图示装置,阳极反应为2H2O-4e-=O2↑+4H+,转移3mol电子时,阳极消耗1.5mol水,产生3molH+进入阴极室,阳极室质量减少27g;阴极反应为2NO2-+6e-+8H+=N2↑+4H2O,阴极室中放出0.5molN2(14g),同时有3molH+(6g)进入阴极室,因此阴极室质量减少11g,膜两侧电解液的质量变化差(△m左-△m右)=27g-11g=16g。
=a×0.14/0.44×12<0.024×0.005/0.042/0.084,解得a>25/8③A.及时分离出CO2 可使平衡向正向移动,反应速率不会增大,A错误。B.适当升高温度,可增大反应速率,此反应是吸热反应,升温逆向移动,B正确。C.减小容器体积使体系压强增大,平衡向气体物质的量减小的方向移动,即正向移动。C错误。D.选择高效催化剂,只改变反应速率,对平衡没有影响,D错误,本题正确选项为B。(3)①根据电化学降解NO2-的原理图可知,Ag/Pt电极上NO2-转化为N2,氮元素化合价从+3价降为0价,被还原,发生还原反应,作为阴极,则电源B为负极,A为正极。阴极反应式为2NO2-+6e-+4H2O=N2↑+8OH-或2NO2-+6e-+8H+=N2↑+4H2O②根据图示装置,阳极反应为2H2O-4e-=O2↑+4H+,转移3mol电子时,阳极消耗1.5mol水,产生3molH+进入阴极室,阳极室质量减少27g;阴极反应为2NO2-+6e-+8H+=N2↑+4H2O,阴极室中放出0.5molN2(14g),同时有3molH+(6g)进入阴极室,因此阴极室质量减少11g,膜两侧电解液的质量变化差(△m左-△m右)=27g-11g=16g。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂。工业上通常用方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:

已知:
①25℃,Ksp(PbS)=1.0×10-28,Ksp(PbCl2)=1.6×10-5
②PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+以氢氧化物形式开始沉淀时的pH值为1.9
(1)由于Ksp(PbS)﹤Ksp(PbCl2),PbS+2HCl![]() PbCl2+H2S的反应程度很小,加入FeCl3能增大反应程度,原因是____________________;步骤①反应过程中可观察到有淡黄色固体生成,总反应的离子方程式为_____________________;该步骤需控制溶液的pH<1.9,主要目的是_______________________。
PbCl2+H2S的反应程度很小,加入FeCl3能增大反应程度,原因是____________________;步骤①反应过程中可观察到有淡黄色固体生成,总反应的离子方程式为_____________________;该步骤需控制溶液的pH<1.9,主要目的是_______________________。
(2)步骤②中饱和食盐水的作用是_________________________。
(3)步骤③中滤液A经过蒸发浓缩、用冰水浴冷却结晶后,还需进行的操作是__________(填操作名称)。
(4)步骤④中,若加入稀硫酸充分反应后所得悬浊液中c(Cl-)=1.0mol·L-1,则c(SO42-)=________[Ksp(PbSO4)=1.6×10-8]。步骤⑤中滤液B用适量试剂X处理后可循环利用,试剂X应选用下列中的_____(填标号)。
a.HNO3 b.Cl2 c.H2O2 d.铁粉
(5)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的铅浓度分数x与溶液pH变化的关系如图所示:

①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH溶液后先变浑浊,继续滴加NaOH溶液又变澄清,pH为13~14时,溶液中发生的主要反应的离子方程式为__________________。
②除去溶液中的Pb2+:科研小组用一种新型试剂(DH)“捕捉”金属离子,从而去除水中的痕量铅和其他杂质离子,实验结果记录如下:
离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
处理前浓度/(mg·L-l) | 0.100 | 29.8 | 0.12 | 0.087 |
处理后浓度/(mg· L-1) | 0.004 | 22.6 | 0.04 | 0.053 |
若新型试剂(DH)在脱铅过程中主要发生的反应为:2DH(s)+Pb2+(aq)![]() D2Pb(s)+2H+(aq),则脱铅时最合适的pH约为_____________。该实验中铅的脱除率为_________________。
D2Pb(s)+2H+(aq),则脱铅时最合适的pH约为_____________。该实验中铅的脱除率为_________________。