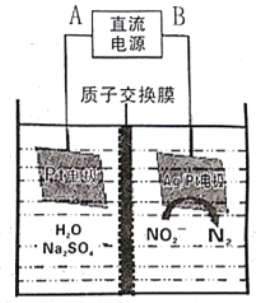
题目内容
【题目】硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂。工业上通常用方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:

已知:
①25℃,Ksp(PbS)=1.0×10-28,Ksp(PbCl2)=1.6×10-5
②PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+以氢氧化物形式开始沉淀时的pH值为1.9
(1)由于Ksp(PbS)﹤Ksp(PbCl2),PbS+2HCl![]() PbCl2+H2S的反应程度很小,加入FeCl3能增大反应程度,原因是____________________;步骤①反应过程中可观察到有淡黄色固体生成,总反应的离子方程式为_____________________;该步骤需控制溶液的pH<1.9,主要目的是_______________________。
PbCl2+H2S的反应程度很小,加入FeCl3能增大反应程度,原因是____________________;步骤①反应过程中可观察到有淡黄色固体生成,总反应的离子方程式为_____________________;该步骤需控制溶液的pH<1.9,主要目的是_______________________。
(2)步骤②中饱和食盐水的作用是_________________________。
(3)步骤③中滤液A经过蒸发浓缩、用冰水浴冷却结晶后,还需进行的操作是__________(填操作名称)。
(4)步骤④中,若加入稀硫酸充分反应后所得悬浊液中c(Cl-)=1.0mol·L-1,则c(SO42-)=________[Ksp(PbSO4)=1.6×10-8]。步骤⑤中滤液B用适量试剂X处理后可循环利用,试剂X应选用下列中的_____(填标号)。
a.HNO3 b.Cl2 c.H2O2 d.铁粉
(5)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的铅浓度分数x与溶液pH变化的关系如图所示:

①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH溶液后先变浑浊,继续滴加NaOH溶液又变澄清,pH为13~14时,溶液中发生的主要反应的离子方程式为__________________。
②除去溶液中的Pb2+:科研小组用一种新型试剂(DH)“捕捉”金属离子,从而去除水中的痕量铅和其他杂质离子,实验结果记录如下:
离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
处理前浓度/(mg·L-l) | 0.100 | 29.8 | 0.12 | 0.087 |
处理后浓度/(mg· L-1) | 0.004 | 22.6 | 0.04 | 0.053 |
若新型试剂(DH)在脱铅过程中主要发生的反应为:2DH(s)+Pb2+(aq)![]() D2Pb(s)+2H+(aq),则脱铅时最合适的pH约为_____________。该实验中铅的脱除率为_________________。
D2Pb(s)+2H+(aq),则脱铅时最合适的pH约为_____________。该实验中铅的脱除率为_________________。
【答案】 Fe3+将H2S氧化,使平衡正向移动 PbS+2Fe3++2Cl-=PbCl2+2Fe2++S 防止Fe3+水解形成沉淀 将PbCl2固体转化为PbCl42-而溶解 过滤、洗涤(或过滤、洗涤、干燥) 1.0×10-3 mol·L-1 b或c或bc Pb(OH)3-+OH-=Pb(OH)42- 6 96%
【解析】分析:本题以方铅矿为原料生产硫酸铅的流程为载体,考查流程的分析、外界条件对化学平衡的影响、离子方程式的书写、溶液pH的控制、基本实验操作、溶度积的计算、图像的分析、Fe3+和Fe2+的相互转化。方铅矿中的PbS与盐酸和FeCl3加热搅拌反应生成PbCl2、S和FeCl2;根据已知②,步骤②中加入饱和食盐水,PbCl2转化为PbCl42-进入滤液A中,滤液A中主要含Fe2+、PbCl42-、Na+、Cl-;由于反应PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)的ΔH
PbCl42-(aq)的ΔH![]() 0,步骤③中滤液A经蒸发浓缩、冰水浴冷却结晶,PbCl42-又转化成PbCl2晶体,经过滤得到的滤液B中主要含Fe2+、Na+、Cl-;步骤④PbCl2晶体中加入稀硫酸实现沉淀的转化得到PbSO4晶体;步骤⑤中加入的试剂X将Fe2+氧化成Fe3+,循环利用。
0,步骤③中滤液A经蒸发浓缩、冰水浴冷却结晶,PbCl42-又转化成PbCl2晶体,经过滤得到的滤液B中主要含Fe2+、Na+、Cl-;步骤④PbCl2晶体中加入稀硫酸实现沉淀的转化得到PbSO4晶体;步骤⑤中加入的试剂X将Fe2+氧化成Fe3+,循环利用。
详解:(1)由于Ksp(PbS)![]() Ksp(PbCl2),PbS+2HCl
Ksp(PbCl2),PbS+2HCl![]() PbCl2+H2S的反应程度很小,加入FeCl3能增大反应程度的原因是:FeCl3与H2S发生反应:2Fe3++H2S=2Fe2++S↓+2H+,H2S浓度减小,使平衡向正反应方向移动。步骤①反应过程中可观察到有淡黄色固体生成,该淡黄色固体为S,总反应的离子方程式为PbS+2Fe3++2Cl-=PbCl2+S+2Fe2+。Fe3+以氢氧化物形式开始沉淀时的pH为1.9,该步骤需控制溶液的pH
PbCl2+H2S的反应程度很小,加入FeCl3能增大反应程度的原因是:FeCl3与H2S发生反应:2Fe3++H2S=2Fe2++S↓+2H+,H2S浓度减小,使平衡向正反应方向移动。步骤①反应过程中可观察到有淡黄色固体生成,该淡黄色固体为S,总反应的离子方程式为PbS+2Fe3++2Cl-=PbCl2+S+2Fe2+。Fe3+以氢氧化物形式开始沉淀时的pH为1.9,该步骤需控制溶液的pH![]() 1.9,主要目的是:防止Fe3+水解形成沉淀。
1.9,主要目的是:防止Fe3+水解形成沉淀。
(2)根据已知②,步骤②中饱和食盐水的作用是:增大c(Cl-),将PbCl2固体转化为PbCl42-而溶解。
(3)步骤③中滤液A经蒸发浓缩、冰水浴冷却结晶,滤液中PbCl42-又转化为PbCl2固体,还需进行的操作是:过滤、洗涤、干燥。
(4)步骤④中的反应为PbCl2(s)+SO42-(aq)![]() PbSO4(s)+2Cl-(aq),该反应的平衡常数K=
PbSO4(s)+2Cl-(aq),该反应的平衡常数K=![]() =
=![]() =
=![]() =
=![]() =103,当c(Cl-)=1.0mol/L,c(SO42-)=c2(Cl-)
=103,当c(Cl-)=1.0mol/L,c(SO42-)=c2(Cl-)![]() 103=1.0
103=1.0![]() 10-3mol/L。滤液B中主要含Fe2+、Na+、Cl-;滤液B加入适量X处理后进入步骤①循环利用,试剂X具有氧化性,能将Fe2+氧化成Fe3+。a项,HNO3能将Fe2+氧化成Fe3+,HNO3被还原成NO,NO污染大气,a项不行;b项,Cl2能将Fe2+氧化成Fe3+,自身被还原成Cl-,b项可以;c项,H2O2能将Fe2+氧化成Fe3+,自身被还原成H2O,c项可以;d项,铁粉不能将Fe2+氧化成Fe3+,d项不行;答案选b或c或bc。
10-3mol/L。滤液B中主要含Fe2+、Na+、Cl-;滤液B加入适量X处理后进入步骤①循环利用,试剂X具有氧化性,能将Fe2+氧化成Fe3+。a项,HNO3能将Fe2+氧化成Fe3+,HNO3被还原成NO,NO污染大气,a项不行;b项,Cl2能将Fe2+氧化成Fe3+,自身被还原成Cl-,b项可以;c项,H2O2能将Fe2+氧化成Fe3+,自身被还原成H2O,c项可以;d项,铁粉不能将Fe2+氧化成Fe3+,d项不行;答案选b或c或bc。
(5)①根据图像,pH为13~14时,随着NaOH的滴入,铅的主要形态的变化是Pb(OH)3-明显减少,Pb(OH)42-明显增多,pH为13~14时,溶液中发生的主要反应的离子方程式为Pb(OH)3-+OH-=Pb(OH)42-。
②脱铅过程中主要发生的反应为:2DH(s)+Pb2+(aq)![]() D2Pb(s)+2H+(aq),pH小于6时上述脱铅反应被抑制;pH为6时,铅的主要存在形态为Pb2+,最有利于脱铅反应;pH大于6时,铅还有Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-等其他形态,Pb2+的浓度分数减小,不利于Pb2+的“捕捉”;故脱铅时最合适pH约为6。该实验中铅的脱除率为
D2Pb(s)+2H+(aq),pH小于6时上述脱铅反应被抑制;pH为6时,铅的主要存在形态为Pb2+,最有利于脱铅反应;pH大于6时,铅还有Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-等其他形态,Pb2+的浓度分数减小,不利于Pb2+的“捕捉”;故脱铅时最合适pH约为6。该实验中铅的脱除率为![]() 100%=96%。
100%=96%。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案