题目内容
【题目】乙炔是一种重要的有机化工原料,已知乙炔二聚反应如下:![]()
三聚同理,现以乙炔为原料在一定条件下发生如下转化:
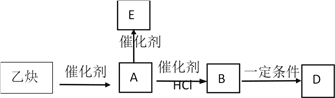
其中A为乙炔的二聚产物;E为乙炔的三聚产物,E分子中有四个碳原子在一条直线上,高分子D的结构为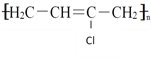 。 回答下列问题:
。 回答下列问题:
(1)乙炔的电子式为_______________________。
(2)用电石制取乙炔的方程式为_____________________________________________。
(3)净化乙炔时,可用_______________(填试剂)除去其中的H2S、PH3等杂质气体。
(4)B的结构简式为______________________,A→B的反应类型为_________________。
(5)E的结构简式为_______________________________。
(6)已知环己烯可由下列物质在一定条件反应下得到:
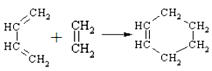 (也可表示为:
(也可表示为: 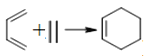 )
)
有机物B在一定条件下反应,生成含六元环的二氯代烃G,G分子式为C8H10Cl2,写出G的结构简式
____________________________(任写两种即可)。
【答案】 ![]() CaC2 + 2H2O = Ca(OH)2 + C2H2↑ CuSO4 溶液 H2C=CH—CCl=CH2 加成反应 H2C=CH—C ≡ C—CH=CH2
CaC2 + 2H2O = Ca(OH)2 + C2H2↑ CuSO4 溶液 H2C=CH—CCl=CH2 加成反应 H2C=CH—C ≡ C—CH=CH2 ![]()
![]()
![]()
![]()
【解析】(1)乙炔的结构简式为CH≡CH,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)用电石制取乙炔的方程式为CaC2 + 2H2O →Ca(OH)2 + C2H2↑,故答案为:CaC2 + 2H2O →Ca(OH)2 + C2H2↑;
(3)实验室制得的乙炔中含有硫化氢等杂质气体,净化乙炔时,可用硫酸铜溶液除去其中的H2S、PH3等杂质气体,故答案为:CuSO4 溶液;
(4)根据题意,A为乙炔的二聚产物;E为乙炔的三聚产物,E分子中有四个碳原子在一条直线上,高分子D的结构为 ,则B为CH2=CHCCl=CH2,A为CH2=CHC≡CH,E为H2C=CH—C ≡ C—CH=CH2,A→B是CH2=CHC≡CH与HCl的加成反应,故答案为:H2C=CH—CCl=CH2;加成反应;
,则B为CH2=CHCCl=CH2,A为CH2=CHC≡CH,E为H2C=CH—C ≡ C—CH=CH2,A→B是CH2=CHC≡CH与HCl的加成反应,故答案为:H2C=CH—CCl=CH2;加成反应;
(5)根据上述分析,E为H2C=CH—C ≡ C—CH=CH2,故答案为:H2C=CH—C ≡ C—CH=CH2;
(6)根据信息 ,有机物B(CH2=CHCCl=CH2)在一定条件下反应,生成含六元环的二氯代烃G,G分子式为C8H10Cl2,是2分子B发生的加成反应,则G的结构简式有:
,有机物B(CH2=CHCCl=CH2)在一定条件下反应,生成含六元环的二氯代烃G,G分子式为C8H10Cl2,是2分子B发生的加成反应,则G的结构简式有: ![]() 、
、![]() 、
、![]() 、
、![]() ,故答案为:
,故答案为:![]() 、
、![]() 、
、![]() 、
、![]() (任写两种)。
(任写两种)。