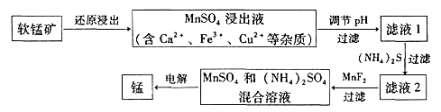
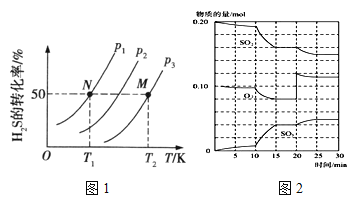
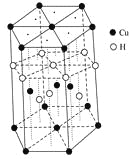
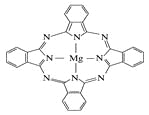
题目内容
【题目】(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ;1 mol O22+中含有的π键数目为____________________。
(2)Fe2(SO4)3晶体中铁离子的核外电子排布式为 。
(3)乙醇与乙醛的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多,其原因是 。
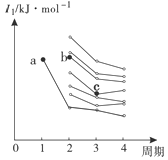
(4)右图是部分主族元素第一电离能梯度图,图中a点对应的元素为氢,b、c两点对应的元素分别为 、 (填元素符号)。
(5)亚硝酸的酸性强于次氯酸的原因为 。
【答案】(1)![]() 2NA
2NA
(2)[Ar]3d5
(3)乙醇分子间存在氢键,而乙醛分子间不存在氢键;
(4)O Si;(5)HNO2中非羟基氧的个数为1,HClO中非羟基氧的个数为0,HNO2中非羟基氧的个数比HClO中非羟基氧的个数多,导致中心原子的正电性高,使羟基上的氢更容易电离。
【解析】
试题分析:(1)CaC2中C22-与O22+互为等电子体,互为等电子体的结构相似,则O22+的电子式可表示为![]() ;单键都是δ键,三键中有1个δ键和2个π键,因此1 mol O22+中含有的π键数目为2NA。
;单键都是δ键,三键中有1个δ键和2个π键,因此1 mol O22+中含有的π键数目为2NA。
(2)Fe2(SO4)3晶体中铁离子的核外电子数是23,其核外电子排布式为[Ar]3d5。
(3)由于乙醇分子间存在氢键,而乙醛分子间不存在氢键,所以乙醇与乙醛的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多。
(4)右图是部分主族元素第一电离能梯度图,图中a点对应的元素为氢,b是第二周期元素,第一电离能排在第三位,则b是O;c是第三周期元素,第一电离能排在第四位,则c是Si;
(5)由于HNO2中非羟基氧的个数为1,HClO中非羟基氧的个数为0,HNO2中非羟基氧的个数比HClO中非羟基氧的个数多,导致中心原子的正电性高,使羟基上的氢更容易电离,因此亚硝酸的酸性强于次氯酸。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案