题目内容
18.将20mL 0.5mol•L-1 K2SO3溶液逐滴加入到20mL 0.2mol•L-1 KMnO4溶液(硫酸酸化)中,溶液恰好褪为无色.写出反应的离子方程式:5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O.分析 求出SO32-的物质的量,然后根据K2SO3做还原剂,硫元素要被高锰酸钾溶液由+4价氧化为+6价,从而表示出硫元素所失去的电子的物质的量为0.02mol;
设Mn元素在还原产物中化合价为a,则0.004mol高锰酸钾溶液得电子的物质的量为0.004×(7-a)mol,根据得失电子数守恒来计算得a=2,即高锰酸钾被还原为Mn2+,据此写出离子方程式.
解答 解:n(SO32-)=0.02L×0.5mol/L=0.01mol,由于K2SO3做还原剂,硫元素要被高锰酸钾溶液由+4价氧化为+6价,从而硫元素所失去的电子的物质的量为0.02mol;
n(MnO4-)=0.02L×0.2mol/L=0.004mol,令Mn元素在还原产物中化合价为a,则:0.02=0.004×(7-a),解得a=2,故生成Mn2+,反应的离子方程式为5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O,
故答案为:5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O.
点评 本题考查了得失电子数守恒思想在氧化还原反应中的运用,本题难在需先根据得失电子数守恒计算出高锰酸钾的还原产物,然后书写离子方程式.

练习册系列答案
相关题目
8.下列物质中既有氧化性又有还原性的是( )
| A. | SO3 | B. | Al2O3 | C. | Na2O2 |
9.下列微粒的存在最能说明碘可能呈现还原性的是( )
| A. | I- | B. | I2 | C. | I2+ | D. | I${\;}_{3}^{-}$ |
6.下列叙述中,正确的是( )
| A. | 纯碱、烧碱均属于碱 | |
| B. | 凡能电离出H+的化合物均属于酸 | |
| C. | 电离出的阴离子全部为OH-的物质为碱 | |
| D. | 盐类物质一定含有金属阳离子 |
13.关于离子方程式Cu2++2OH-═Cu(OH)2↓的说法正确的是( )
| A. | 可表示所有铜盐和强碱的反应 | |
| B. | 可表示某一个具体的反应,也可以表示一类反应 | |
| C. | 离子方程式中的OH-可代表弱碱或强碱 | |
| D. | 该反应可看到Cu(OH)2白色沉淀 |
3.某溶液中加入过量稀H2SO4后,有S和H2SO3生成,则原溶液中可能含有( )
| A. | Na2S2O3 | |
| B. | Na2SO3和Na2S且物质的量比值小于$\frac{1}{2}$ | |
| C. | Na2SO3和Na2S且物质的量比值大于$\frac{1}{2}$ | |
| D. | Na2S2O3和Na2S且物质的量比值小于$\frac{1}{2}$ |
10.在密闭容器中进行如下反应:A2(g)+B2(g)?2D(g),已知A2、B2、D的起始浓度分别为0.2mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A. | B2为0.1mol/L | B. | D为0.3mol/L | ||
| C. | A2为0.3mol/L | D. | B2为0.2mol/L同时D为0.1mol/L |
13.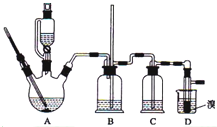 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高170℃左右,其最主要目的是d.
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层下(填“上”、“下”).
(4)若产物中有少量副产物乙醚,可用的方法除去蒸馏.
(5)反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是避免溴大量挥发;产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态、溶解性 | 无色液体、易溶于水 | 无色液体 | 无色液体、难溶于水 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高170℃左右,其最主要目的是d.
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层下(填“上”、“下”).
(4)若产物中有少量副产物乙醚,可用的方法除去蒸馏.
(5)反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是避免溴大量挥发;产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
14.在硫化氢饱和溶液中,加入适量下列试剂后,不能使溶液的酸性增强的是( )
| A. | 亚硫酸 | B. | 胆矾 | C. | 氯水 | D. | 盐酸 |