题目内容
13.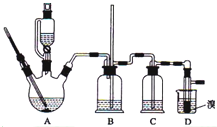 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态、溶解性 | 无色液体、易溶于水 | 无色液体 | 无色液体、难溶于水 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高170℃左右,其最主要目的是d.
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层下(填“上”、“下”).
(4)若产物中有少量副产物乙醚,可用的方法除去蒸馏.
(5)反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是避免溴大量挥发;产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
分析 实验室制备1,2-二溴乙烷:三颈烧瓶A中发生反应是乙醇在浓硫酸的作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
如果D中导气管发生堵塞事故,A中产生的乙烯气体会导致装置B中压强增大,长导管液面会上升,所以装置B中长玻璃管可判断装置是否堵塞,装置B起缓冲作用,浓硫酸具有脱水性、吸水性和强氧化性,能氧化乙醇,CH3CH2OH+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4SO2↑+CO2↑+7H2O+C,可能生成的酸性气体为二氧化硫、二氧化碳,装置C中放氢氧化钠溶液,发生反应SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH═Na2CO3+H2O,除去杂质气体,乙烯含有不饱和键C=C双键,能卤素单质发生加成反应,D中乙烯和溴加成生成1,2-二溴乙烷,反应为:CH2=CH2+Br-Br→CH2Br-CH2Br,制得1,2-二溴乙烷.
(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚;
(2)乙烯和溴水发生加成反应,溴的颜色完全褪去,表明该制备反应已经结束;
(3)根据1,2-二溴乙烷和水的密度相对大小解答;
(4)利用1,2-二溴乙烷与乙醚的沸点不同进行解答;
(5)溴易挥发,该反应放热,产品1,2-二溴乙烷的熔点(凝固点)低,不能过度冷却(如用冰水),否则使气路堵塞.
解答 解:(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚,2CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O,要尽可能迅速地把反应温度提高170℃左右,其最主要目的是:减少副产物乙醚生成,
故答案为:d;
(2)溴水为橙黄色,乙烯和溴水发生加成反应反应为:CH2=CH2+Br-Br→CH2Br-CH2Br,生成的1,2-二溴乙烷为无色,溴的颜色完全褪去,表明该制备反应已经结束,
故答案为:溴的颜色完全褪去;
(3)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,
故答案为:下;
(4)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,
故答案为:蒸馏;
(5)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,过度冷却会凝固而堵塞导管,
故答案为:避免溴大量挥发;产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
点评 本题考查有机物合成实验,主要考查了乙醇制备1,2-二溴乙烷,涉及制备原理、物质的分离提纯、实验条件控制、对操作分析评价等,是对基础知识的综合考查,需要学生具备扎实的基础,难度中等.

 阅读快车系列答案
阅读快车系列答案a.取25mL NaOH溶液,向其中通入过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸此溶液1~2min;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应.
(1)此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应方程式:NaOH+CO2═NaHCO3、NaHCO3+NaOH═Na2CO3+H2O.
(2)煮沸溶液的目的是充分将溶液中的二氧化碳赶出.此方案第一步的实验装置如图所示:

(3)加入反应物前,如何检查整个装置的气密性用弹簧夹夹住A、B连接处,先检查A的气性:塞紧橡皮塞,从漏斗注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,停止加水后,漏斗内与锥形瓶中的液面差保持不变,说明装置不漏气.然后检查B的气密性:向烧杯中注入少量水,使导管口侵入水中,双手捂住广口瓶片刻有气泡冒出,松开手后,有少量水进入导管形成水柱,说明装置不漏气(也可一次检查A、B的气密性:连接和烧杯间的乳胶管用止水夹夹住.然后从漏斗注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,过一会,观察漏斗内与锥形瓶中的液面差,若保持不变,说明装置不漏气).
(4)装置B中盛放的试剂是饱和NaHCO3溶液,作用是吸收HCl气体.
(5)在实验室制法中,装置A还可作为下列②④⑤气体的发生装置(填序号).
①CH2=CH2 ②H2S ③CH4 ④CH≡CH ⑤H2
(6)实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4,⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理并能用图所示装置进行处理的,将气体的序号填入装置图的下方空格内.
| 尾 气 吸 收 装 置 |  |  |
| 处理气体 | ①③ | ②④ |
| A. | mol | B. | g/mol | C. | g | D. | mol/L |

 甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇.