题目内容
7.C5H12有3种不同结构:甲CH3(CH2)3CH3,乙CH3CH(CH3)CH2CH3,丙C(CH3)4.下列相关叙述正确的是( )| A. | 甲、乙、丙属同系物均可与氯气、溴蒸气发生取代反应 | |
| B. | C5H12表示一种纯净物 | |
| C. | 甲、乙、丙中,丙的沸点最低 | |
| D. | 乙有3种不同沸点的二氯取代物 |
分析 A.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;
B.有机物无同分异构体的才是纯净物;
C.沸点:正戊烷>异戊烷>新戊烷;
D.先找一氯代物,再找二氯代物.
解答 解:A.CH3(CH2)3CH3、CH3CH(CH3)CH2CH3、C(CH3)4是分子式相同,结构不同,属于同分异构体,不是同系物,均可与氯气、溴蒸气发生取代反应,故A错误;
B.C5H12存在3种同分异构体:CH3(CH2)3CH3、CH3CH(CH3)CH2CH3、C(CH3)4,不能表示纯净物,故B错误;
C.沸点:正戊烷>异戊烷>新戊烷,即甲、乙、丙中,丙的沸点最低,故C正确;
D.(CH3)4的二氯取代物有2种CHCl2C(CH3)3、(CH2Cl)2C(CH3)2,即有2种不同沸点的二氯取代物,故D错误;
故选C.
点评 本题主要考查了物质的结构与分类,难度不大,注意相应规律的掌握.

练习册系列答案
相关题目
20.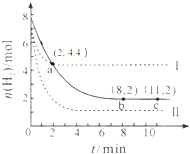 某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
 某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )| A. | 曲线Ⅰ对应的条件改变可能降低温度 | |
| B. | 曲线Ⅱ对应的条件改变可能是充入氦气 | |
| C. | 该温度下,此反应的化学平衡常数的数值为0.5 | |
| D. | 从反应开始至a 点,ν(CO2)=0.6 mol•L-1•min-1 |
2.下列各种说法正确的是( )
①在水中氢、氧原子间均以化学键相结合
②金属和非金属化合时一定形成离子键
③离子键是阳离子、阴离子的相互吸引力
④冰的密度比水的密度小,这与氢键有关
⑤根据电离方程式HCl═H++Cl-,推断HCl分子里存在离子键.
①在水中氢、氧原子间均以化学键相结合
②金属和非金属化合时一定形成离子键
③离子键是阳离子、阴离子的相互吸引力
④冰的密度比水的密度小,这与氢键有关
⑤根据电离方程式HCl═H++Cl-,推断HCl分子里存在离子键.
| A. | ①⑤ | B. | 都不正确 | C. | ④ | D. | ⑤ |
12.在密闭容器中某气态烃和氧气按一定比例混合,点火爆炸后恢复到原温度(20℃),体积减小至原来的一半,若甲NaOH的溶液则气体全部被吸收,则此烃为( )
| A. | C2H6 | B. | C2H2 | C. | C2H4 | D. | C2H3 |
19.烃分子中若含有双键,叁键或单键的环,氢原子数就少,分子就不饱和,即具有一定的“不饱和度”,其数值可表示为:不饱和度(Ω)=双键数+环数+叁键数×2,则有机物 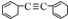 的不饱和度为( )
的不饱和度为( )
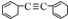 的不饱和度为( )
的不饱和度为( )| A. | 8 | B. | 7 | C. | 6 | D. | 10 |
16.下列有关物质结构的说法正确的是( )
| A. | 78gNa2O2晶体中所含离子数约为1.806×1024 | |
| B. | 4.48L氨气分子中含0.6NA个N-H键 | |
| C. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| D. | N2H4分子中极性键和非极性键的比值为1:4 |
14.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 5.6g Fe和足量的盐酸反应时,失去的电子数为0.3NA | |
| B. | 1 mol Na2O2固体中含离子总数为3NA | |
| C. | 标准状况下,22.4 L SO3所含分子数为NA | |
| D. | 0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA |