题目内容
12.在密闭容器中某气态烃和氧气按一定比例混合,点火爆炸后恢复到原温度(20℃),体积减小至原来的一半,若甲NaOH的溶液则气体全部被吸收,则此烃为( )| A. | C2H6 | B. | C2H2 | C. | C2H4 | D. | C2H3 |
分析 反应后加NaOH的溶液则气体全部被吸收,说明气态烃与氧气混合后恰好完全反应生成生成二氧化碳和水,容器内反应后气体的物质的量为是反应前的一半,恢复到原温度(20℃),水为液体,结合方程式计算.
解答 解:设此烃的化学式为CxHy,则有
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O
1 x+$\frac{y}{4}$ x
体积减小至原来的一半,可知1+x+$\frac{y}{4}$=2x
解得:4x=4+y,
若x=1,则y=0,不存在此物质,
若x=2,则y=4,物质为C2H4,
若x=3,则y=8,物质为C3H8,
故选:C.
点评 本题考查了利用方程式进行的讨论计算,难度不大,关键判断烃与氧气混合后恰好完全反应生成生成二氧化碳和水,再依据化学方程式中气体前面的化学计量数进行计算.

练习册系列答案
相关题目
3.某非金属元素X的最高化合价为+m,其最高价氧化物的水化物的分子中有b个氧原子,则该元素氢化物的分子式为( )
| A. | Hm+2bX | B. | Hm-2bX | C. | Hm-8X | D. | H8-mX |
20.短周期元素A、B、C、D在元素周期表中的相对位置如图所示,A和D的质子数之和为22.下列说法正确的是( )
| A | B | ||
| C | D |
| A. | A、C、D的最高价氧化物对应水化物的酸性强弱顺序:D>C>A | |
| B. | B和C形成的化合物具有两性 | |
| C. | C的阳离子与B的阴离子的电子层结构不同 | |
| D. | D元素的最简单氢化物的热稳定性大于B元素的最简单氢化物 |
7.C5H12有3种不同结构:甲CH3(CH2)3CH3,乙CH3CH(CH3)CH2CH3,丙C(CH3)4.下列相关叙述正确的是( )
| A. | 甲、乙、丙属同系物均可与氯气、溴蒸气发生取代反应 | |
| B. | C5H12表示一种纯净物 | |
| C. | 甲、乙、丙中,丙的沸点最低 | |
| D. | 乙有3种不同沸点的二氯取代物 |
17.X、Y、Z、W四种主族元素,若X的阳离子与Y的阴离子具有相同的电子层结构;W的阳离子的氧化性强于等电荷数的X阳离子的氧化性;Z的阴离子半径大于等电荷数的Y的阴离子半径,则四种元素的原子序数由大到小的顺序是( )
| A. | ZYXW | B. | WXYZ | C. | XYZW | D. | ZXYW |
4.化学与环境密切相关,下列说法不正确的是( )
| A. | 二氧化碳是形成酸雨的主要物质 | |
| B. | 随意丢弃废电池会对生态环境造成危害 | |
| C. | 任意排放工业废水会导致土壤和水源的污染 | |
| D. | 燃煤时加入适量的石灰可减少二氧化硫的排放 |
19.如图是氯气的制备以及氯、溴、碘的非金属性比较实验,充分反应一段时间后,打开装置D的活塞,将装置D中少量溶液加入装置E中,振荡,观察实验现象,下列说法正确的是( ) 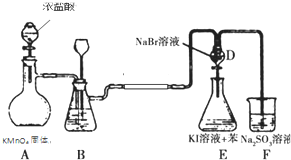

| A. | F2不能与NaCl溶液反应置换出氯气 | |
| B. | 装置B中可盛放水吸收氯气中的HCl气体 | |
| C. | 装置E下层呈现紫红色 | |
| D. | 装置E中有机试剂层呈现紫红色,能说明非金属性Br>I |



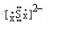 .
.