题目内容
【题目】铝在生活中具有广泛用途。现从含铝废料(含有A12O3的质量分数为51%,其余为NiO、SiO2、Fe3O4)中制取金属铝的流程如下:
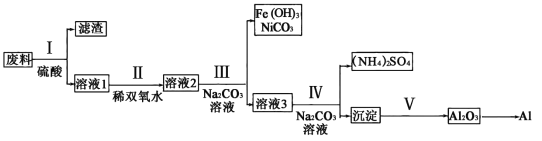
回答下列问题:
(1)工艺过程中常把废料研细,其目的是_________________________________。
(2)步骤I中得到的滤渣的主要成分是___________(填化学式)。步骤V的反应类型是______________________。
(3)步骤Ⅱ中加入稀双氧水的目的是______________________。
(4)步骤Ⅲ产生NiCO3的离子方程式是___________。步骤Ⅳ产生沉淀的离子方程式是______________________。
(5)工业中常用惰性电极熔融电解法制备金属铝,其阴极反应式为___________。
(6)若用a吨该含铝废料通过上述流程,理论上可以生产铝___________吨
【答案】增大接触面积,加快反应速率,使反应更充分,提高原料转化率 SiO2 分解 将Fe2+氧化为Fe3+ Ni2++ CO32—= NiCO3↓ 2Al3+ + 3CO32-+3H2O= 2Al(OH)3↓ + 3CO2↑ Al3++3e—=Al 0.27a
【解析】
由实验流程可知,铝废料中加入加硫酸, Al2O3转化为Al3+,Fe3O4转化为Fe2+、Fe3+,NiO转化为Ni2+,只有SiO2不反应,则过滤得到的滤渣I为SiO2;向滤液中加入过氧化氢,过氧化氢与亚铁离子发生氧化还原反应,使Fe2+转化为Fe3+,加入碳酸钠溶液调节溶液pH,使铁离子转化为氢氧化铁沉淀、Ni2+转化为NiCO3沉淀;过滤,向滤液中继续加入碳酸钠溶液,碳酸钠溶液和硫酸铝溶液发生双水解反应生成Al(OH)3沉淀和硫酸铵;Al(OH)3沉淀灼烧分解得到氧化铝;一定条件下电解熔融氧化铝得到Al。
(1)工艺过程中常把废料研细,可以增大废料的表面积,增大与硫酸的接触面积,加快反应速率,使反应更充分,故答案为:增大接触面积,加快反应速率,使反应更充分,提高原料转化率;
(2)步骤I中加入硫酸,Al2O3、Fe3O4、NiO与硫酸反应,只有SiO2不反应,则过滤得到的滤渣I为SiO2;步骤V为Al(OH)3沉淀灼烧分解得到氧化铝,故答案为:SiO2;分解;
(3)步骤Ⅱ中加入稀双氧水,双氧水与亚铁离子发生氧化还原反应,使Fe2+转化为Fe3+,故答案为:将Fe2+氧化为Fe3+;
(4)步骤Ⅲ,加入碳酸钠溶液调节溶液pH,使铁离子转化为氢氧化铁沉淀、Ni2+转化为NiCO3沉淀,产生NiCO3的离子方程式为:Ni2++ CO32—= NiCO3↓;步骤Ⅳ向滤液中继续加入碳酸钠溶液,碳酸钠溶液和硫酸铝溶液发生双水解反应生成Al(OH)3沉淀和硫酸铵,反应的离子方程式为2Al3+ + 3CO32-+3H2O= 2Al(OH)3↓ + 3CO2↑,故答案为:Ni2++ CO32—= NiCO3↓;2Al3+ + 3CO32-+3H2O= 2Al(OH)3↓ + 3CO2↑;
(5)工业上用惰性电极电解熔融氧化铝制备金属铝,阴极上铝离子放电生成金属铝,电极反应式为Al3++3e—=Al,故答案为:Al3++3e—=Al;
(6)由Al原子个数守恒可得:A12O3~2Al,则a吨该含铝废料理论上可以生产铝的质量为![]() =0.27ag,故答案为:0.27a。
=0.27ag,故答案为:0.27a。