题目内容
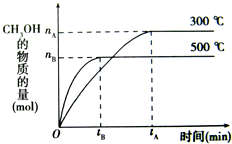 一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)?CH3OH(g)达到平衡状态.
一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)?CH3OH(g)达到平衡状态.(1)该反应的平衡常数表达式K=
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
减小
减小
(填“增大”、“减小”或“不变”)(2)500℃时,从反应开始到达到平衡状态,以H2的浓度变化表示的化学反应速率是υ(H2)=
| ||
| tB |
| ||
| tB |
(3)判断可逆反应达到平衡状态的标志是
c、d
c、d
(填字母)a.υ生成(CH3OH)=υ消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度不再改变
(4)300℃时,将容器的容积压缩到原来的
| 1 |
| 2 |
c、d
c、d
(填字母).a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时c(H2)/C(CH3OH)减小.
分析:(1)根据化学平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积列平衡常数的表达式,根据升高温度平衡乙醇的变化判断平衡常数的变化;
(2)根据化学反应速率是υ(H2)=2υ(CH3OH)计算;
(3)达到平衡时,正逆反应速率相等,混合气体的平均相对分子质量不再改变,CO、H2、CH3OH的浓度不再改变;
(4)将容器的容积压缩到原来的
,压强增大,反应速率增大,平衡向正反应方向移动,以此判断;
(2)根据化学反应速率是υ(H2)=2υ(CH3OH)计算;
(3)达到平衡时,正逆反应速率相等,混合气体的平均相对分子质量不再改变,CO、H2、CH3OH的浓度不再改变;
(4)将容器的容积压缩到原来的
| 1 |
| 2 |
解答:解;(1)化学平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,反应物的生成物都是气体,平衡常数表达式为K=
,由图象可知升高温度乙醇的物质的量减少,平衡向逆反应方向移动,K减小,故答案为:K=
,减小;
(2)υ(H2)=2υ(CH3OH)=
,故答案为:
;
(3)达到平衡时,正逆反应速率相等,混合气体的平均相对分子质量不再改变,CO、H2、CH3OH的浓度不再改变,在体积不变时,气体的密度不变,不能作为判断是否达到平衡状态的依据,故答案为:c、d;
(4)将容器的容积压缩到原来的
,压强增大,正逆反应速率都增大,平衡向正反应方向移动,CH3OH的物质的量增加,氢气的物质的量减少,但浓度增大,甲醇的物质的量增多,故有
减小,故选c、d,故答案为:c、d.
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
(2)υ(H2)=2υ(CH3OH)=
| ||
| tB |
| ||
| tB |
(3)达到平衡时,正逆反应速率相等,混合气体的平均相对分子质量不再改变,CO、H2、CH3OH的浓度不再改变,在体积不变时,气体的密度不变,不能作为判断是否达到平衡状态的依据,故答案为:c、d;
(4)将容器的容积压缩到原来的
| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
点评:本题考查化学平衡的影响因素和化学平衡的标志等问题,题目难度不大,注意外界条件对化学平衡移动的影响以及平衡状态的判断角度.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)根据题意完成下列各题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)根据题意完成下列各题: 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g),下列有关说法正确的是( )
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g),下列有关说法正确的是( )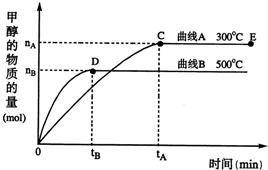 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO): CH3OH(g)
CH3OH(g) 2Cu+CO2
2Cu+CO2
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).根据题意完成下列各题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO).根据题意完成下列各题: