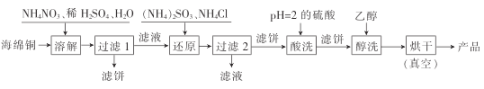
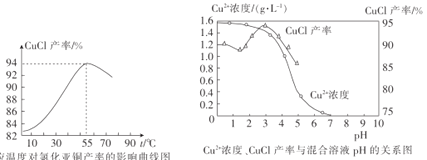
题目内容
【题目】下列说法正确的是
A. 燃料电池化学能100%转化为电能
B. 酶催化发生的反应,温度越高化学反应速率一定越快
C. 为减缓浸入海水中的钢铁水闸的腐蚀,可在其表面镶上铜锭
D. 向0.1mol/L氨水中加入少量水,溶液中![]() 增大
增大
【答案】D
【解析】
A.燃料电池化学能大部分转化为电能,还有一部分转化为热能和化学能,A错误;
B.酶催化发生的反应,温度升高,酶会失去其生理活性,所以化学反应速率不一定加快,B错误;
C.若在钢铁水闸表面镶上铜锭,Fe、Cu及海水构成原电池,由于Fe活动性比Cu强,为原电池的负极,因此会导致钢铁水闸腐蚀加快,C错误;
D.在氨水中存在一水合氨的电离平衡,若向其中加入少量水,电离平衡正向移动,c(OH-)减小,电离常数不变,则溶液中![]() 增大,D正确;
增大,D正确;
故合理选项是D。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景,可用![]() 等作为催化剂,采用如下反应来合成甲醇:
等作为催化剂,采用如下反应来合成甲醇:![]()
(1)下表是有关化学键的键能数据,计算表中的a=__________。
化学键 |
|
|
|
|
|
键能 | 436 | 462.8 | a | 1075 | 351 |
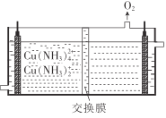
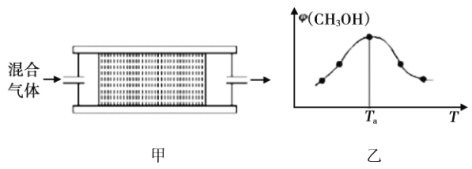
(2)将![]() 的混合气体,匀速通过装有催化剂的反应器反应(如图甲),反应器温度变化与从反应器排出气体中
的混合气体,匀速通过装有催化剂的反应器反应(如图甲),反应器温度变化与从反应器排出气体中![]() 的体积分数φ关系如图乙,φ(CH3OH)变化的原因是__________。
的体积分数φ关系如图乙,φ(CH3OH)变化的原因是__________。
(3)某学习小组模拟工业合成甲醇的反应,在![]() 的恒容密闭容器内充入
的恒容密闭容器内充入![]() 和
和![]() ,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如表:
,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如表:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
从反应开始到![]() 时,
时,![]() 的平均反应速率为______,该温度下的平衡常数
的平均反应速率为______,该温度下的平衡常数![]() 为______。
为______。
(4)另将![]() 和
和![]() 加入密闭容器中,在一定条件下发生上述反应。平衡时
加入密闭容器中,在一定条件下发生上述反应。平衡时![]() 的体积分数(%)与温度和压强的关系如图所示(虚线框表示没有测定该条件下的数据)。
的体积分数(%)与温度和压强的关系如图所示(虚线框表示没有测定该条件下的数据)。
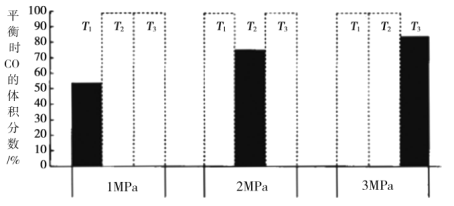
![]() 由大到小的关系是__________,判断理由是__________。
由大到小的关系是__________,判断理由是__________。
【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将SO2气体通入Ba(NO3)2溶液 | 有白色沉淀 | SO2中混有SO3 |
B | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
C | AgCl悬浊液中滴入少量Na2S溶液 | 沉淀变黑色 | Ksp(Ag2S)>Ksp(AgCl) |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在平衡: I3- |
A. A B. B C. C D. D