题目内容
【题目】工业上用粗CuO制备CuCl2晶体的流程如下:
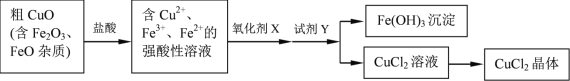
各种离子相关数据如下:
Fe2+ | Cu2+ | Fe3+ | |
开始转化成氢氧化物沉淀时的pH | 7.0 | 4.7 | 1.9 |
完全转化成氢氧化物沉淀时的pH | 9.0 | 6.7 | 3.2 |
请回答:
(1)CuO溶于盐酸的离子方程式是_______________。
(2)已知NaClO为强氧化剂,能将Fe2+氧化为Fe3+。
① NaClO溶液显_______性(填“酸”或“碱”)。你认为用NaClO作氧化剂X是否妥当__________(填“是”或“否”),理由是__________。
②下列另有几种常用的氧化剂,可用作氧化剂X的是__________。
a 浓H2SO4 b C12 c H2O2
(3)试剂Y的作用是调节溶液的pH=3.2,将Fe3+转化为Fe(OH)3沉淀,过滤后得到CuCl2溶液。下列试剂中适宜的是___________。
a NaOH b Na2CO3 c CuCO3 d CuO
(4)为了得到符合质量标准的CuCl2溶液,必须控制溶液的pH____________。
【答案】CuO+2H+ = Cu2++H2O 碱 否 因NaClO溶液显碱性,会将Cu2+转化成沉淀,而且会引入杂质 bc cd 不能高于4.7
【解析】
粗CuO粉末(含有Fe2O3和FeO杂质)加入浓盐酸并加热得到含有Cu2+、Fe2+、Fe3+的混合溶液,通入氯气,可将氯化亚铁氧化生成氯化铁,然后加入CuO或CuCO3,调节溶液的pH,使Fe3+生成氢氧化铁沉淀,过滤除去氢氧化铁溶液,滤液为氯化铜溶液,应降温结晶、过滤得到氯化铜晶体,以此解答该题。
(1)CuO溶于盐酸生成CuCl2和水,发生反应的离子方程式是CuO+2H+ = Cu2++H2O;
(2)① NaClO是强碱弱酸盐,在NaClO溶液中ClO-水解,使溶液显碱性;因NaClO溶液显碱性,会将Cu2+转化成沉淀,而且会引入Na+及过量的ClO-,影响CuCl2晶体的纯度,故用NaClO作氧化剂X不妥当;
②选择氧化X时需要考虑氧化Fe2+生成Fe3+的同时不能引入新的杂质,结合最终产物为CuCl2,则不能选用浓硫酸,会引入SO42-,而应选择Cl2或H2O2,故答案为bc;
(3)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,同时不能引入新杂质,则可用CuO 或CuCO3,故答案为cd;
(4)Fe3+沉淀完全时pH=3.2,Cu2+开始沉淀时溶液pH=4.7,则为了得到符合质量标准的CuCl2溶液,必须控制溶液的pH不能高于4.7。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】t ℃时,在容积不变的密闭容器中发生反应X(g)+3Y(g) ![]() 2Z(g),各组分在不同时刻的浓度如表所示,下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如表所示,下列说法正确的是( )
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2 min时浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.平衡后,增大体系压强,v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L-1·min-1